题目内容
4.医院里检验糖尿病的方法是:将病人尿液加入到CuSO4和NaOH的混合液中,加热后若产生红色沉淀,则说明病人的尿液中含有( )| A. | 葡萄糖 | B. | 乙酸 | C. | 蛋白质 | D. | 脂肪 |
分析 含-CHO的有机物与新配制氢氧化铜悬浊液反应生成砖红色沉淀,以此来解答.
解答 解:选项中只有葡萄糖含-CHO,加入到CuSO4和NaOH的混合液中,加热后若产生红色沉淀,则说明病人的尿液中含有葡萄糖,B、C、D均不能出现此现象,
故选A.
点评 本题考查物质的鉴别,为高频考点,把握有机物的官能团与性质、有机反应为解答的关键,侧重分析与实验能力的考查,注意化学与生活的联系,题目难度不大.

练习册系列答案
相关题目
14.一种测定水样中溴离子的浓度的实验步骤如下:
①向锥形瓶中加入处理后的水样25.00mL,加入几滴NH4Fe(SO4)2溶液.
②加入V1mL c1mol•L-1 AgNO3溶液(过量),充分摇匀.
③用c2mol•L-1KSCN标准溶液进行滴定,至终点时消耗标准溶液V2mL.
(已知:Ksp(AgBr)=7.7×10-13,Ag++SCN-═AgSCN(白色)↓,Ksp(AgSCN)=1×10-12)下列说法不正确的是( )
①向锥形瓶中加入处理后的水样25.00mL,加入几滴NH4Fe(SO4)2溶液.
②加入V1mL c1mol•L-1 AgNO3溶液(过量),充分摇匀.
③用c2mol•L-1KSCN标准溶液进行滴定,至终点时消耗标准溶液V2mL.
(已知:Ksp(AgBr)=7.7×10-13,Ag++SCN-═AgSCN(白色)↓,Ksp(AgSCN)=1×10-12)下列说法不正确的是( )
| A. | 滴定终点时,溶液变为红色 | |
| B. | 该滴定法需在碱性条件下进行 | |
| C. | AgBr(s)+SCN-?AgSCN(s)+Br-(aq)的平衡常数K=0.77 | |
| D. | 该水样中溴离子浓度为:c(Br-)=$\frac{({c}_{1}{V}_{1}-{c}_{2}{V}_{2})}{25.00}$mol/L |
15.卤块的主要成分是MgCl2,此外还含有Fe3+、Fe2+和Mn2+等离子.若以它为原料按如图所示工艺流程进行生产,可制得轻质氧化镁.

要求产品尽量不含杂质,而且生产成本较低,请根据表中提供的资料,回答下列问题.
原料价格表
(1)在步骤②中加入的试剂X,最佳的选择是漂液,其作用是将亚铁离子氧化成三价铁离子;
(2)在步骤④中加入的试剂Y是碳酸钠;
(3)在步骤⑤中发生反应的化学方程式是H2O+MgCO3$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+CO2↑.

要求产品尽量不含杂质,而且生产成本较低,请根据表中提供的资料,回答下列问题.
原料价格表
| 物质 | 价格/(元•吨-1) |
| 漂液(含25.2%NaClO) | 450 |
| 双氧水(30%H2O2) | 2400 |
| 烧碱(含98%NaOH) | 2100 |
| 纯碱(含99.5%Na2CO3) | 600 |
(2)在步骤④中加入的试剂Y是碳酸钠;
(3)在步骤⑤中发生反应的化学方程式是H2O+MgCO3$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+CO2↑.
12.金属晶体的下列性质中,不能用金属晶体结构加以解释的是( )
| A. | 易导电 | B. | 易导热 | C. | 有延展性 | D. | 易锈蚀 |
19.下列反应的离子方程式不正确的是( )
| A. | 锌与硫酸铜溶液反应:Zn+Cu2+═Zn2++Cu | |
| B. | 氢氧化钠与盐酸反应:OH-+H+═H2O | |
| C. | 氢氧化钡与硫酸反应:Ba2++SO42+═BaSO4↓ | |
| D. | 铁与稀盐酸反应:Fe+2H+═Fe2++H2↑ |
9.化学与材料、生活和环境密切相关.下列有关说法中正确的是( )
| A. | 煤炭经蒸馏、气化和液化等过程,可获得清洁能源和重要的化工原料 | |
| B. | 医药中常用酒精来消毒,是因为酒精能够使细菌蛋白发生变性 | |
| C. | “海水淡化”可以解决淡水供应危机,向海水中加入明矾可以使海水淡化 | |
| D. | 新型材料聚酯纤维、光导纤维都属于有机高分子化合物 |
16.下列说法不正确的是( )
| A. | 取c(H+)=0.01mol/L的盐酸和醋酸各100mL,分别稀释2倍后,再分别加入0.03g锌粉,在相同条件下充分反应,醋酸与锌反应的速率大 | |
| B. | 含等物质的量的NaHC2O4和Na2C2O4的溶液中存在:2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] | |
| C. | 25℃时,某溶液中由水电离出的c(H+)=10-amol/L,若a>7时,该溶液pH一定为14-a | |
| D. | 25℃时,pH=11 NaOH溶液和pH=3 CH3COOH混合,若溶液显酸性,则所得溶液中离子浓度可能为c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
13.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 1.0 mol•L-1的KNO3溶液:H+、Fe2+、Cl-、SO42- | |
| B. | 饱和氯水中:NH4+、SO32-、AlO2-、Cl- | |
| C. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- | |
| D. | c(H+)=1.0×10-13mol/L溶液中:K+、Na+、CH3COO-、Br- |
5.回答下列相关问题:
(1)用“>”或“<”填写表:
(2)某半导体材料由X、Y两种元素组成,已知X的基态原子4p轨道上只有1个电子,Y的基态原子L层上有3个未成对电子.X位于周期表第四周期IIIA族;该半导体材料的化学式为GaN
(3)由极性共价键构成的非极性分子是d(填序号).
a.P4b.COS c.CH3OCH3 d.BCl3
(4)雷氏盐(Reinecke's salt)结构式如图所示:
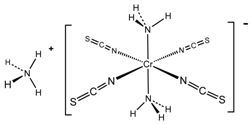
配离子中Cr3+的配体为NH3和NCS-(填化学式),Cr3+与配体间形成的共价键又称为配位键.
(1)用“>”或“<”填写表:
| 电负性 | 第一电离能 | 熔点 | 沸点(同压) | 在水中溶解性 |
| C>H | S<P | NaF>KCl | PH3<NH3 | CH3OH>CH3SH |
(3)由极性共价键构成的非极性分子是d(填序号).
a.P4b.COS c.CH3OCH3 d.BCl3
(4)雷氏盐(Reinecke's salt)结构式如图所示:

配离子中Cr3+的配体为NH3和NCS-(填化学式),Cr3+与配体间形成的共价键又称为配位键.