题目内容
【题目】粗盐中除含有Ca2+、Mg2+、SO42-等可溶性杂质外,还含有泥砂等不溶性杂质。
(1)检验溶液中含有SO42-的方法是_________________。
(2)将粗盐溶解过滤除去不溶性杂质后,在滤液中依次滴加过量NaOH溶液、BaCl2溶液和Na2CO3溶液,直至不再产生沉淀。这些操作的目的是_________________,滴加Na2CO3溶液时发生反应的化学方程式为________________。
(3)用提纯后的NaCl固体配制100mL l.0mol/LNaCl溶液,所用仪器除托盘天平、烧杯、玻璃棒、药匙外,还需要___________(填仪器名称)。转移溶液时没有洗涤烧杯会造成所配溶液浓度偏______(填“高”或“低”,下同),定容时仰视刻度线会造成所配溶液浓度偏____________。
【答案】 取少量溶液,滴加足量盐酸,再加入几滴氯化钡溶液,若有白色沉淀生成,则说明有SO42- 依次除去Mg2+、SO42-、Ca2+和多余的Ba2+ BaCl2+Na2CO3 = BaCO3↓+2NaCl、CaCl2+Na2CO3= CaCO3↓+2NaCl l00mL容量瓶、胶头滴管 低 低
【解析】试题分析:(1)SO42-的检验通常选用盐酸和氯化钡溶液,方法是:取适量溶液于试管中,滴加足量盐酸,再滴加几滴BaCl2溶液,有白色沉淀生成,说明溶液中含有SO42-;(2)滴加过量NaOH溶液使Mg2+完全沉淀而除去,滴加过量BaCl2溶液使SO42-完全沉淀而除去,滴加过量Na2CO3溶液使Ca2+和过量的Ba2+完全沉淀而除去,达到除去不溶性杂质的旷目的;滴加Na2CO3溶液时发生反应的化学方程式为BaCl2+Na2CO3 = BaCO3↓+2NaCl;CaCl2+Na2CO3 = CaCO3↓+2NaCl;(3)配制一定物质的量浓度的溶液最重要的仪器是容量瓶以及定容时的胶头滴管,故所用仪器除托盘天平、烧杯、玻璃棒、药匙外,还需要100mL容量瓶和胶头滴管;转移溶液时没有洗涤烧杯,溶质部分损失,根据c=![]() ,可知,所配溶液浓度偏低;定容时仰视刻度线,则所加溶液体积偏大,根据c=
,可知,所配溶液浓度偏低;定容时仰视刻度线,则所加溶液体积偏大,根据c=![]() ,可知,造成所配溶液浓度偏低。
,可知,造成所配溶液浓度偏低。

【题目】(14分)某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4 ·4H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
① | 4 | B= | 10 | 30 |
② | 5 | 60 | 10 | d= |
③ | a= | 60 | c= | 20 |
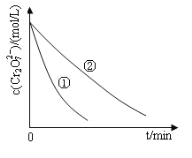
测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示。
(2)上述反应后草酸被氧化为 (填化学式);
(3)实验①和②的结果表明_______________________________;
(4)该课题组对铁明矾[Al2Fe(SO4)4 ·4H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;假设二: ;假设三: ;……
(5)请你设计实验验证上述假设一,完成下表中内容。(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。(溶液中Cr2O72-的浓度可用仪器测定)
实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
取_______________________________代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验 | 反应进行相同时间后, 若溶液中的Cr2O72-浓度____________________________则假设一成立; 若溶液中的Cr2O72-浓度____________________________则假设一不成立; |
(6)铁明矾长期存放,其中的亚铁离子可能会变质。为测定铁明矾中亚铁离子的质量分数。取5.6g铁明矾晶体,将其配制为100ml的溶液,取出20ml置于锥形瓶中。用0.01mol/L的标准KMnO4溶液进行滴定(还原产物为Mn2+),平行做4组实验,得出如下表数值。
组数 | 1 | 2 | 3 | 4 |
消耗V(KMnO4)/ml | 20.04 | 20.00 | 18.90 | 19.96 |
请计算铁明矾中亚铁离子的质量分数: 。若滴定结束后读数时仰视,测定结果 (填“偏大”“不影响”或“偏小”)