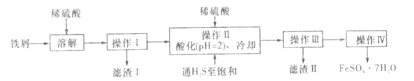
题目内容
【题目】已知(1)H2O(g) = H2O(l) ΔH1=-Q1 kJ·mol-1
(2)CH3OH(g) = CH3OH(l) △H2=-Q2 kJ·mol-1
(3)2CH3OH(g) +3O2(g) = 2CO2(g)+4H2O(g) △H3=-Q3 kJ·mol-1
(Q1、Q2、Q3均大于0)若要使1mol液态甲醇完全燃烧,最后恢复到室温,放出的热量为(单位:kJ)( )
A. Q1+ Q2 + Q3 B. 0.5Q3-Q2+2Q1 C. Q3-2Q2+4Q1 D. 0.5(Q1+Q2+Q3)
【答案】B
【解析】已知(1)H2O(g) = H2O(l) ΔH1=-Q1 kJ·mol-1
(2)CH3OH(g) = CH3OH(l) △H2=-Q2 kJ·mol-1
(3)2CH3OH(g) +3O2(g) = 2CO2(g)+4H2O(g) △H3=-Q3 kJ·mol-1
由盖斯定律可知,③-②×2+①×4得:2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(l)△H=△H33-△H22-△H3=-(Q3-2Q2+4Q1)kJ·mol-1,1mol液态甲醇完全燃烧放出热量为![]() ×(Q3-2Q2+4Q1)kJ·mol-1=(0.5Q3-Q2+2Q1)kJ。故选B。
×(Q3-2Q2+4Q1)kJ·mol-1=(0.5Q3-Q2+2Q1)kJ。故选B。

练习册系列答案
 口算题天天练系列答案
口算题天天练系列答案
相关题目