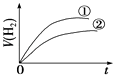
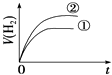
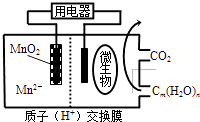
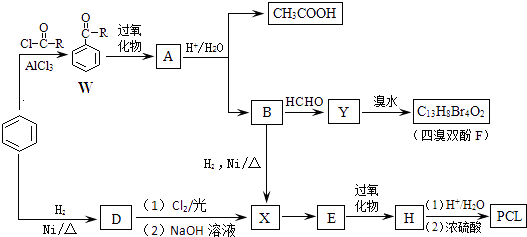
��Ŀ����
����Ŀ��ij������Ʒ���ܺ���NH4HCO3��NH4Cl��NH4NO3�е�һ�ֻ��֣���ȡ����Ʒ1.000�ˣ�����ˮ���100mL��Һ������Һ�ֳ����ȷ������������ʵ��:
����һ����Һ�м���10mL 0.2mol/L��������֮��ַ�Ӧ�����ռ�����״���µ�CO2����44.8mL(�������CO2ȫ���ݳ�)��
������һ����Һ�м���������6mol/L����������Һ�����ȣ����������壨�������NH3ȫ���ݳ���������Ҫ25mL 0.15mol/L��������ܱ���ȫ��Ӧ������˵����ȷ����
A. 1.000g��Ʒ��һ������NH4HCO3 0.316��
B. ��ٷ�Ӧ���õ���Һ�м��������ữ����������Һ�����а�ɫ�������ɣ�˵��ԭ��Ʒ��һ������NH4C1
C. ԭ��Ʒ�ĺ�����Ϊ21%
D. �������������ʵ����֤������ȷ��ԭ��Ʒ���Ƿ���NH4Cl
���𰸡�D
��������A���ɢ����ݿ���֪������0.002 mol HCl������0.002 mol CO2��˵��HCl��ȫ��Ӧ��������ȷ��NH4HCO3�Ƿ���ȫ��Ӧ��A�����B�����м������ᣬ���������ӣ���˲���ȷ���Ƿ���NH4Cl��B�����C�����ݢڼ����֪���������ʵ���=0.00375![]() 2=0.0075 mol��1.000 g��Ʒ������0.0015 mol��������Ʒ�е�NԪ��������NH4+��NO3-����������21%��C�����D������C���з�����֪NH4HCO3��NH4Cl��NH4NO3��0.015 mol������ƽ��Ħ������Ϊ
2=0.0075 mol��1.000 g��Ʒ������0.0015 mol��������Ʒ�е�NԪ��������NH4+��NO3-����������21%��C�����D������C���з�����֪NH4HCO3��NH4Cl��NH4NO3��0.015 mol������ƽ��Ħ������Ϊ![]() =66.7 g/mol��NH4Cl��Ħ������С��66.7 g/mol����һ������NH4Cl��D����ȷ����ѡD��
=66.7 g/mol��NH4Cl��Ħ������С��66.7 g/mol����һ������NH4Cl��D����ȷ����ѡD��

 ��ʦ�㲦��ϵ�д�
��ʦ�㲦��ϵ�д�