题目内容
将相对分子质量为M 的某气体VL(标准状况下)溶于10mL水中,所得溶液密度为
d g/mL,则此溶液的物质的量浓度为( mol/L)
d g/mL,则此溶液的物质的量浓度为( mol/L)
A.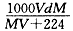 | B.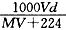 | C. | D. |
B
试题分析:溶质的物质的物质的量为V/22.4mol,而溶液的体积为(V/22.4*M+10)/d*10-3L.利用公式带入即可。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
题目内容
A.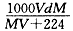 | B.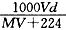 | C. | D. |

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案