题目内容
【题目】按要求回答问题:
(1)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如下图所示。

组成M的元素中,电负性最大的是__________(填名称)。
(2)钛元素基态原子未成对电子数为________个,能量最高的电子占据的能级符号为________。
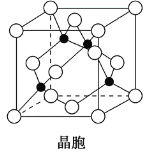
(3)①已知Al 的第一电离能为578 kJ·mol-1、第二电离能为1 817 kJ·mol-1、第三电离能为2 745 kJ·mol-1、第四电离能为11 575 kJ·mol-1。请解释其第二电离能增幅较大_______________________________。Al单质为面心立方晶体,其晶胞参数a=0.405 nm,晶胞中铝原子的配位数为________。
②第二电离能I(Cu)________(填“>”或“<”)I (Zn)。
(4)在硅酸盐中,SiO44—四面体[如下图(a)]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式。
图(b)为一种无限长单链结构的多硅酸根(其中硅原子数为n):其中Si原子的杂化形式为_________,Si与O的原子数之比为__________,化学式为____________。

【答案】氧元素 2 3d 基态Al原子失去一个电子后,剩余电子在3s能级处于全充满状态,能量较低较稳定,则第二电离能增幅较大 12 > sp3 1:3 [SiO3]n2n-
【解析】
(1)根据组成M的元素及相应电负性解答;
(2)根据钛元素基态原子核外价电子排布式确定未成对电子数及能量最高的能级符号;
(3)①电子处于充满或半充满状态时,能量较低,较稳定,则电离能较高;面心立方晶体中面心原子距离顶角原子距离相等且最近,确定配位数;
(4)用分摊法进行求解;
(1)组成M的元素为Ti、C、H、O、Cl,其中O的电负性最大;
(2)钛元素基态原子核外价电子排布式为:3d24s2,则3d能级含有2个未成对电子;能量最高的电子占据的能级符号3d;
(3)①基态Al原子的价电子排布式为3s3p1,失去一个电子后,剩余电子在3s能级处于全充满状态,较稳定,则第二电离能增幅较大;Al单质为面心立方晶体,面心铝原子距离顶角铝原子距离相等且最近,则配位数为3×8/2=12;
②基态Cu原子价电子排布式为3d104s1,基态Zn原子价电子排布式为3d104s2,Cu原子失去1个电子后为全充满,能量较低,而Zn原子失去1个电子后,为半充满,还易失去一个电子,则第二电离能I(Cu)>I(Zn);
(4)根据图(b)的一个结构单元含有1个硅原子,氧原子2+2×1/2=3个,则Si与O的原子数之比为1:3,硅和氧的化合价分别为+4和-2,则该多硅酸根的化学式为[SiO3]n2n-,则中心Si原子孤电子对数=1/2×(4+2-2×3)=0,1个Si原子与4个氧原子形成共价键,故其为sp3杂化。

 阅读快车系列答案
阅读快车系列答案【题目】斑蝥素具有良好的抗肿瘤活性。下列是斑蝥素的一种合成路线:

已知:ⅰ.其它条件不变,通常反应物浓度越大速率越快,多步反应时速率由最慢反应决定;
ⅱ.狄尔斯阿尔德反应:![]()
(1)有机化合物A的分子式为__。
(2)A转化为B时,路线Ⅰ和路线Ⅱ均在水溶液中进行。实验发现:路线Ⅰ比路线Ⅱ所需时间短,试解释原因__。
(3)写出B→C的化学方程式__。
(4)D与乙二醇发生缩聚反应的化学方程式为__。
(5)①X的结构简式是__。
②下表研究了__对合成F的影响,合成F的较优条件为__(填编号)。
编号 | 离子液体X | 反应温度/℃ | 反应时间/h | E含量/% | F含量/% | |
1 | [BPy]BF4 | 45 | 20 | 90 | 9 | |
2 | [HMIM]PF6 | 35 | 20 | 5 | 93 | |
3 | [BMIM]BF4 | 25 | 30 | 0 | 90 | |
4 | [HMIM]BF4 | 35 | 20 | 38 | 57 | |
5 | [BMIM]BF4 | 25 | 20 | 0 | 86 |
(6)请写出以![]() 为原料制备
为原料制备 的合成路线流程图__(无机试剂任选,合成路线流程图示见本题题干)。
的合成路线流程图__(无机试剂任选,合成路线流程图示见本题题干)。