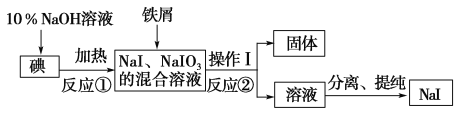
题目内容
【题目】以下可逆反应,在给定的条件下一定达到了化学平衡状态的是 ( )
A.N2(g)+3H2(g)![]() 2NH3(g)[在混合气体中φ(NH3)=33.3%
2NH3(g)[在混合气体中φ(NH3)=33.3%
B.CO (g)+H2O(g)![]() CO2(g)+H2(g)(在恒容容器中,容器内压强不再改变
CO2(g)+H2(g)(在恒容容器中,容器内压强不再改变
C.2SO2(g)+O2(g)![]() 2SO3(g)(在恒压条件下,总质量不再改变
2SO3(g)(在恒压条件下,总质量不再改变
D.2NO2(g)![]() NO(g)+O2(g)(在恒容条件下,气体颜色不再改变
NO(g)+O2(g)(在恒容条件下,气体颜色不再改变
【答案】D
【解析】
试题分析:A.在混合气体中φ(NH3)=33.3%,不表示φ(NH3)不变化,可能是平衡建立过程中一种情况,不能说明达到了化学平衡状态,故A错误;B.CO(g)+H2O(g) ![]() CO2(g)+H2(g),反应前后气体的物质的量一直不变,在恒容容器中,容器内压强始终改变,不能说明达到了化学平衡状态,故B错误;C.2SO2(g)+O2(g)
CO2(g)+H2(g),反应前后气体的物质的量一直不变,在恒容容器中,容器内压强始终改变,不能说明达到了化学平衡状态,故B错误;C.2SO2(g)+O2(g) ![]() 2SO3(g),在恒压条件下,总质量始终不变,不能说明达到了化学平衡状态,故C错误;D.2NO2(g)
2SO3(g),在恒压条件下,总质量始终不变,不能说明达到了化学平衡状态,故C错误;D.2NO2(g) ![]() NO(g)+O2(g),在恒容条件下,气体颜色不再改变,表示二氧化氮的浓度不变,能够说明达到了化学平衡状态,故D正确;故选D。
NO(g)+O2(g),在恒容条件下,气体颜色不再改变,表示二氧化氮的浓度不变,能够说明达到了化学平衡状态,故D正确;故选D。

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目