题目内容
8.填写下列空白:(1)写出表示含有8个质子、10个中子的原子的化学符号:8180.
(2)周期表中位于第8纵行的铁元素属于第VIII族.
(3)周期表中最活泼的非金属元素位于第17纵行.
(4)所含元素超过18种的周期是第6、7周期
(5)请写出298K,101KPa时,下列反应的热化学方程式用CO(g)还原1mol Fe2O3(s)放热24.8KJ3CO(g)+Fe2O3(s)=2Fe(s)+3CO2(g)△H=-24.8kJ/mol.
分析 (1)质子数=原子序数,质子数+中子数=质量数,根据原子表示法来回答;
(2)根据元素周期表中元素和周期以及族的分布知识来回答;
(3)同主族元素的原子,从上到下元素的非金属性逐渐减弱,同周期元素的原子,从左到右元素的非金属性逐渐增强;
(4)根据元素周期表中元素的分布知识来回答;
(5)用CO(g)还原l mol Fe203(s),放热24.8kJ,热化学方程式为:3CO(g)+Fe2O3(s)=2Fe(s)+3CO2(g)△H=-24.8 kJ/mol.
解答 解:(1)质子数=原子序数,质子数决定元素种类,所以含有8个质子的元素是O,并且质子数+中子数=质量数,所以该元素的质量数是18,表示为8180,
故答案为:8180;
(2)周期表中位于第8纵列的铁元素属于VIII族,故答案为:VIII;
(3)根据元素周期律:同主族元素的原子,从上到下元素的非金属性逐渐减弱,同周期元素的原子,从左到右元素的非金属性逐渐增强,所以非金属性最强的是F,位于第17纵列,属于第ⅥⅠA族,故答案为:17;
(4)元素周期表中,在第6、7(或六、七)周期的第ⅢB族出现镧系和锕系元素,所含元素种数最多,故答案为:6;7;
(5)用CO(g)还原l mol Fe203(s),放热24.8kJ,标注物质聚集状态和对应焓变得到热化学方程式为:3CO(g)+Fe2O3(s)=2Fe(s)+3CO2(g)△H=-24.8 kJ/mol,
故答案为:3CO(g)+Fe2O3(s)=2Fe(s)+3CO2(g)△H=-24.8 kJ/mol.
点评 本题考查原子的构成及元素在周期表中的位置和性质,注重基础,难度不大,明确元素周期表的结构是解答本题的关键.

练习册系列答案
 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案
相关题目
19.某有机物的蒸气,完全燃烧时消耗的氧气体积和生成的二氧化碳体积都是它本身体积的2倍.该有机物可能是( )
①C2H4 ②H2C═C═O(乙烯酮) ③CH3CHO ④CH3COOH.
①C2H4 ②H2C═C═O(乙烯酮) ③CH3CHO ④CH3COOH.
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ③④ |
3.下列物质属于苯的同系物的是( )
①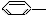 CH3 ②
CH3 ②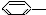 CH=CH2
CH=CH2
③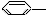 NO2 ④
NO2 ④ OH
OH
⑤ ⑥
⑥ CH-(CH3)2.
CH-(CH3)2.
①
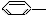 CH3 ②
CH3 ②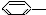 CH=CH2
CH=CH2 ③
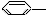 NO2 ④
NO2 ④ OH
OH ⑤
 ⑥
⑥ CH-(CH3)2.
CH-(CH3)2.| A. | ③④ | B. | ②⑤ | C. | ①⑥ | D. | ①②⑤⑥ |
13.卤代烃RCH2CH2X的化学键如图,则下列说法中正确的是( )
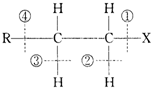

| A. | 该卤代烃发生水解反应时,被破坏的键是①和④ | |
| B. | 该卤代烃发生消去反应时,被破坏的键是①和③ | |
| C. | 当该卤代烃发生水解反应时,被破坏的键是① | |
| D. | 当该卤代烃发生消去反应时,被破坏的键是①和② |
20.W、X、Y、Z、R为五种短周期主族非金属元素,它们在元素周期表中的相对位置如图所示.下列关于五种元素的说法正确的是( )
| W | X | R | |
| Y | Z |
| A. | 粒子半径:原子半径最大的是W,简单阴离子半径最小的是R | |
| B. | 单质:氧化性最强的是Z,还原性最强的是Y | |
| C. | 最高价氧化物对应水化物:酸性最强的是Z,水溶性最差的是Y | |
| D. | 最简单氢化物:沸点最高的是X,稳定性最差的是W |
17.桶烯(Barrelene)结构简式如图所示,则下列有关说法一定正确的是( )
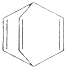

| A. | 0.1mol桶烯完全燃烧需要消耗氧气22.4L | |
| B. | 桶烯在一定条件下能发生加成反应,不能发生加聚反应 | |
| C. | 桶烯二氯取代产物只有三种 | |
| D. | 桶烯与苯乙烯(C6H5CH=CH2)互为同分异构体 |
18.有8种物质:①甲烷;②苯;③聚乙烯;④异戊二烯;⑤2-丁炔;⑥环己烷;⑦邻二甲苯;⑧环己烯.既能使酸性高锰酸钾溶液褪色又能与溴水反应使之褪色的是( )
| A. | ③④⑤⑧ | B. | ④⑤⑦⑧ | C. | ④⑤⑧ | D. | ③④⑤⑦⑧ |
