题目内容
【题目】设NA 表示阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,0. 1mol Cl2 溶于水,转移的电子数目为0. 1NA
B.常温常压下,18g H2O 中含有的原子总数为3NA
C.标准状况下,11. 2L CCl4中含有的分子数目为0. 5NA
D.常温常压下,2. 24L CO 和CO2 混合气体中含有的碳原子数目为0. 1NA
【答案】B
【解析】
A. 标准状况下,氯气与水反应是可逆反应,因此0. 1mol Cl2溶于水,转移的电子数目小于0.1NA,故A错误;
B. 常温常压下,18g H2O物质的量![]() ,含有的原子总数为3NA,故B正确;
,含有的原子总数为3NA,故B正确;
C. 标准状况下,CCl4是液体,不能用气体摩尔体积来计算,故C错误;
D. 常温常压下,不是标准状况下,不能用22.4Lmol1进行计算,故D错误。
综上所述,答案为D。

【题目】Ⅰ.宜城市鄂西化工厂以铬铁矿(主要成分为 FeO 和 Cr2O3,含有 Al2O3、SiO2 等杂质)为主要原料生产化工原料红矾钠(主要成分 Na2Cr2O7·2H2O),工艺流程如下图:
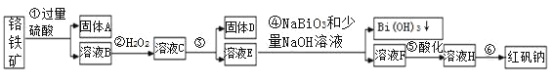
i.常温,NaBiO3不溶于水,有强氧化性,碱性条件下,能将Cr3+转化为 CrO42-。ii.
金属离子 | Fe3+ | Al3+ | Cr3+ | Fe2+ | Bi3+ |
开始沉淀的pH | 2.7 | 3.4 | 5.0 | 7.5 | 0.7 |
沉淀完全的pH | 3.7 | 4.9 | 5.9 | 9.7 | 4.5 |
(1)步骤③需加氢氧化钠溶液,此时pH要调到5的目的是__________________。
(2)写出④反应的离子方程式____________________________________。
(3)将溶液 H 经过蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠粗晶体,精制红矾钠粗晶体需要采用的操作是______________(填操作名称)。
Ⅱ.经检测鄂西化工厂的工业废水中含 5.00×10-3 mol·L-1 的 Cr2O72-,其毒性较大。该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料 Cr0.5Fe1.5FeO4(Fe 的化合价依次为+3、+2),又设计了如下工艺流程:
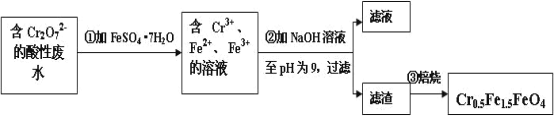
(1)第①步反应的离子方程式是_________________________________________。
(2)欲使 1L 该废水中的 Cr2O72-完全转化为 Cr0.5Fe1.5FeO4。理论上需要加入FeSO4·7H2O的质量为_________g (已知 FeSO4·7H2O 的摩尔质量为 278 g/mol)。