题目内容
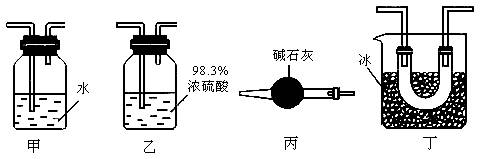
工业上用固体硫酸亚铁制取颜料铁红(Fe2O3),反应原理是2FeSO4![]() Fe2O3+SO2↑+SO3↑。课外活动小组在实验室做这一实验时,为除去混合气中的SO3得到纯净的SO2气体,应选用下图中哪种实验装置?请将标号及实验原理填入表中(有几种填几种)。(SO2沸点为-10.02℃)
Fe2O3+SO2↑+SO3↑。课外活动小组在实验室做这一实验时,为除去混合气中的SO3得到纯净的SO2气体,应选用下图中哪种实验装置?请将标号及实验原理填入表中(有几种填几种)。(SO2沸点为-10.02℃)
|
选用装置(标号) |
简答实验原理 |
|
|
|
|
|
|
答案:
解析:
解析:
乙; SO3+H2O=H2SO3,不形成酸雾,有利于吸收,而SO2可通过; 丁; SO3冷凝,SO2通过。
|

练习册系列答案
相关题目
工业上用固体硫酸亚铁制取颜料铁红(Fe2O3)反应原理是:2FeSO4Fe2O3+SO2↑+SO3↑,某学生欲检验该反应所产生的气态物质,依次将气体通过盛有(Ⅰ)BaCl2溶液、(Ⅱ)X溶液、(Ⅲ)NaOH溶液的三个装置。则下列对该方案的评价中正确的是( )
| A.(Ⅰ)中会生成BaSO3、BaSO4两种沉淀 |
| B.可将(Ⅰ)中的BaCl2溶液改为Ba(NO3)2溶液 |
| C.(Ⅱ)所盛X可为品红溶液 |
| D.(Ⅲ)的作用是吸收有毒的SO2气体 |

