题目内容
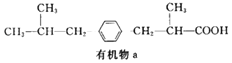
【题目】W、X、Y和Z为原子序数依次增大的四种短周期主族元素。X在短周期元素中原子半径最大,Y的最高正价与最低负价代数和为0,Z是所在周期非金属性最强的元素,W、X、Y三种元素形成的一种化合物结构如右图所示。下列叙述不正确的是
![]()
A.W和X形成的化合物的水溶液呈碱性
B.气态氢化物稳定性:Z>Y
C.右图化合物中W和Y均满足8电子稳定结构
D.可用pH试纸测定Z单质水溶液的pH
【答案】D
【解析】
W、X、Y和Z为原子序数依次增大的四种短周期主族元素,由X在短周期元素中原子半径最大可知,X为Na元素;由Y的最高正价与最低负价代数和为0可知,Y为Si元素;由Z是所在周期非金属性最强的元素可知,Z为Cl元素;由化合物的结构可知,W能形成2个共价键,是O元素。
A.O和Na形成的化合物为氧化钠或过氧化钠,氧化钠或过氧化钠溶于水,与水反应生成氢氧化钠的碱性溶液,故A正确;
B.元素的非金属性越强,气态氢化物稳定性越强,氯元素的非金属性强于硅元素,则气态氢化物稳定性Cl>Si,故B正确;
C.由化合物的结构可知,化合物中氧原子和硅原子均满足8电子稳定结构,故C正确;
D.氯水中含有具有强氧化性的次氯酸,次氯酸能使有机色质漂白褪色,无法用pH试纸测定氯水的pH,故D错误;
故选D。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案【题目】探索CO和NO2这类化合物的特征及反应机理,对处理该类化合物的污染问题具有重要意义。回答下列问题:
I.CO可以与H2反应制备合成天然气(SNG)。涉及反应如下:
CO甲烷化:CO(g)+3H2(g)CH4(g)+H2O(g)![]() 1=-206.2kJ·mol-1
1=-206.2kJ·mol-1
水煤气变换:CO(g)+H2O(g)CO2(g)+H2(g)![]() 2=-41.2kJ·mol-1
2=-41.2kJ·mol-1
(1)反应CO2(g)+4H2(g) CH4(g)+2H2O(g)的![]() =_____kJ·mol-1。某温度下,分别在起始体积相同的恒容容器A、恒压容器B中加入1molCO2和4molH2的混合气体,两容器反应达平衡后放出或吸收的热量较多的是_____(填“A”或“B”)。
=_____kJ·mol-1。某温度下,分别在起始体积相同的恒容容器A、恒压容器B中加入1molCO2和4molH2的混合气体,两容器反应达平衡后放出或吸收的热量较多的是_____(填“A”或“B”)。
(2)在恒压管道反应器中将原料气H2和CO按一定比例通入,在催化剂作用下制备合成天然气,400℃、p总为100kPa时反应体系平衡组成如表所示。
组分 | CH4 | H2O | H2 | CO2 | CO |
体积分数 | 45.0 | 42.5 | 10.0 | 2.00 | 0.500 |
该条件下CO的总转化率α=______。若将管道反应器升温至500℃,反应达到平衡后CH4的体积分数![]() ______45.0%(填“>”、“<”或“=”)。
______45.0%(填“>”、“<”或“=”)。
II.NO2可发生二聚反应生成N2O4,化学方程式为2NO2![]() N2O4。该反应达到平衡后,升高温度可使体系颜色加深。
N2O4。该反应达到平衡后,升高温度可使体系颜色加深。
(3)已知该反应的正反应速率方程为υ正=k正·c2(NO2),逆反应速率方程为υ逆=k逆·c(N2O4),其中k正、k逆分别为正、逆反应的速率常数。则右图(lgk表示速率常数的对数;![]() 表示温度的倒数)所示①、②、③、④四条斜线中,能表示lgk正随
表示温度的倒数)所示①、②、③、④四条斜线中,能表示lgk正随![]() 变化关系的是斜线______,能表示lgk逆随
变化关系的是斜线______,能表示lgk逆随![]() 变化关系的是斜线______。
变化关系的是斜线______。
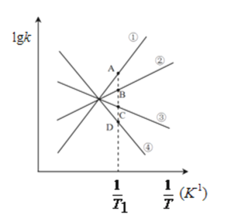
(4)图中A、B、C、D点的纵坐标分别为a+1.5、a+0.5、a-0.5、a-1.5,则T1温度时化学平衡常数K=______mol-1·L。已知T1温度时,某时刻恒容密闭容器中NO2、N2O4浓度均为0.2mol·L-1,此时υ正______υ逆(填>或<);该反应达到平衡后,若将温度从T1升高到T2重新达到平衡,则T1温度时平衡压强p(T1)______T2温度时平衡压强p(T2)(填“>”、“=”或“<”),原因是______。