题目内容
有一实验如图a所示,将一定量的Ba(OH)2溶液置于烧杯中,然后边搅拌边慢慢加入溶质的质量分数一定的H3PO4溶液(一种三元弱酸).加入磷酸溶液的体积V和电流强度I的变化关系I-V图如图b所示.

(1)处于AB之间时,溶液中导电的阴离子主要是:________;
(2)烧杯中刚加入H3PO4时,观察到的现象是:________;
(3)图b中,从A→B电流强度I变小的主要原因是:________.
答案:
解析:
解析:
|
(1) (2)产生白色沉淀 (3)生成难溶物Ba3(PO4)2和难电离的水,溶液中单位体积的离子数目减小,故导电性减弱 导解:H3PO4是三元弱酸要分步电离,所以AB间溶液中存在的阴离子主要有H3PO4三级电离出的产物及Ba(OH)2未反应完的OH-. 由于在溶液中发生反应: 3Ba(OH)2+2H3PO4=Ba3(PO4)2↓+6H2O(AB段) BaHPO4+H3PO4=Ba2++2 在刚加入H3PO4时发生第一个反应,产生Ba3(PO4)2白色沉淀,而AB之间由于生成难溶物Ba3(PO4)2和难电离的H2O,溶液中单位体积的离子数目减少,故导电性减弱. |

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目
 ,
, ,OH-
,OH- (CD段)
(CD段)

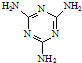 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸( 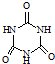 )后,三聚氰酸与三聚氰胺分子相互之间通过
)后,三聚氰酸与三聚氰胺分子相互之间通过