��Ŀ����
����Ŀ���Ȼ���ͭ(CuCl)�������л��ϳɹ�ҵ�еĴ������ڳ�ʪ��������ˮ��������������ֽ⣬��ɺ�ɫ��CuCl�����ڴ���ˮ��������������Ũ�Ƚϴ����ϵ����ͼ�ǹ�ҵ��������ӡˢ��·�ķ�Һ����Fe3+��Cu2+��Fe2+��Cl-��
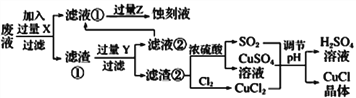
����������Ϣ�ش��������⣺
��1��д�������������������ʵ����ƣ�____________��________________��
��2��д������CuCl�Ļ�ѧ����ʽ��________________________________��
��3����CuCl�����ɹ����������ϲ���Ҫ����SO2���壬��ϻ�ѧ����ʽ�ͱ�Ҫ������˵������________________________________________________��ʵ��������SO2Ҫ�ʵ�������ԭ�������___����һ�㼴�ɣ���
��4���õ�CuC1�������Ҫ����ˮϴ���Ҵ�ϴ���������������Ҵ�ϴ�ӵ�������________________��
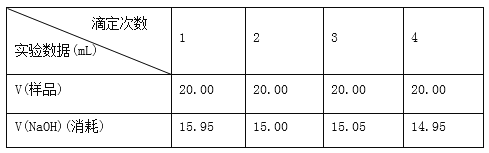
��5��ʵ��̽��pH��CuCl���ʵ�Ӱ�����±���ʾ��
pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
CuCl���� | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
����CuCl�������pHΪ_________����pH�ϴ�ʱCuCl���ʱ��ԭ����________________��
��6���Ȼ���ͭ�Ķ���������
�ٳ�ȡ��Ʒ0.25g������FeCl3��Һ��250mL��ƿ�У�����ܽ⡣
����0.10molL-1���������Һ�ζ�����֪��CuCl+FeCl3�TCuCl2+FeCl2��Fe2++Ce4+�TFe3++Ce3+������ƽ��ʵ�������£�ƽ��ʵ�������ܳ���1%����
ƽ��ʵ����� | 1 | 2 | 3 |
0.25g��Ʒ�������������Һ�������mL�� | 24.35 | 24.05 | 23.95 | /tr>
����Ʒ��CuCl�Ĵ���Ϊ_______________�����������λ��Ч���֣���
���𰸡� �� ϡ���� CuCl2��CuSO4��SO2��2H2O===2CuCl����2H2SO4 ��ӦCu��2H2SO4(Ũ)![]() CuSO4��SO2����2H2O�����ɵ�CuSO4�� SO2Ϊ1��1�����������ϲ���Ҫ����SO2���� �� ��ϴ�����ӿ�ȥ��CuCl����ˮ�֣���ֹ��ˮ������ 2 pH�ϴ�ʱ��Cu2��ˮ��̶�����Ӧ���ɵ�CuCl���� 0.955(��95.5%)
CuSO4��SO2����2H2O�����ɵ�CuSO4�� SO2Ϊ1��1�����������ϲ���Ҫ����SO2���� �� ��ϴ�����ӿ�ȥ��CuCl����ˮ�֣���ֹ��ˮ������ 2 pH�ϴ�ʱ��Cu2��ˮ��̶�����Ӧ���ɵ�CuCl���� 0.955(��95.5%)
��������(1)ӡˢ��·�ķ�Һ(��![]() ��
��![]() ��
��![]() ��
��![]() ������,�����������ܹ�ԭ����Ӧ���ɶ���������,ͭ�����ܹ�������Ӧ����ͭ,���˺������к���ͭ����,��������,�������ᷴӦ�����Ȼ�����,ͭ�������Ӧ,��ͭ�����������ˣ����õ����������ۡ�ϡ���ᡣ
������,�����������ܹ�ԭ����Ӧ���ɶ���������,ͭ�����ܹ�������Ӧ����ͭ,���˺������к���ͭ����,��������,�������ᷴӦ�����Ȼ�����,ͭ�������Ӧ,��ͭ�����������ˣ����õ����������ۡ�ϡ���ᡣ
(2)����ͼʾ����֪��: CuCl2��CuSO4��SO2��H2O��Ӧ����H2SO4��CuCl,���ݵ�ʧ�����غ��䷽��ʽΪ: CuCl2��CuSO4��SO2��2H2O===2CuCl����2H2SO4
(3)����ͼʾ����֪��: ��ӦCu��2H2SO4(Ũ)![]() CuSO4��SO2����2H2O
CuSO4��SO2����2H2O
��Ӧ�����ɵ�CuSO4��SO2Ϊ1:1,���������ϲ���Ҫ����SO2����;
ʵ��������Ҫ�����ʵ�������![]() ,Ŀ�������
,Ŀ�������![]() �Ļ�ԭ����,ͬʱ���Է�ֹ���ɵ�
�Ļ�ԭ����,ͬʱ���Է�ֹ���ɵ�![]() ����������,
����������,
��4����ϴ�����ӿ�ȥ��CuCl����ˮ�֣���ֹ��ˮ������
��5��)����ͼ��CuCl���ʿ���֪��![]() �������Ϊ
�������Ϊ![]() ,��pH�ϴ�ʱCuCl���ʱ��,
,��pH�ϴ�ʱCuCl���ʱ��,![]() ˮ��̶�����,���ɵ�CuCl��;
ˮ��̶�����,���ɵ�CuCl��;
��6��������Ŀ���������ݼ�ƽ��ʵ�������ܳ���1%,���Ϊ![]() ,������ȥ,�ζ�
,������ȥ,�ζ�![]() ��Ʒ�������������Һ��ƽ�����
��Ʒ�������������Һ��ƽ�����![]() ,��Ϸ���ʽ����֪��:
,��Ϸ���ʽ����֪��:![]() �T
�T![]() ,
,![]() ,
,![]() CuCl�Ĵ���
CuCl�Ĵ���![]() ;
;

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�