题目内容
17.下列说法正确的是( )| A. | 若把H2S写成H3S,则违背了共价键的饱和性 | |
| B. | H3O+的存在说明共价键不应有饱和性 | |
| C. | 所有共价键都有方向性 | |
| D. | 两原子轨道发生重叠后,电子在两核间出现的概率减小 |
分析 A.S最外层有6个电子,只能结合2个H;
B.H3O+中形成了配位键;
C.s-s键没有方向性;
D.两原子轨道发生重叠后,电子在两核间出现的概率增大.
解答 解:A.S最外层有6个电子,只能结合2个H,形成H2S分子,若写成H3S分子,违背了共价键的饱和性,故A正确;
B.H3O+的存在,是由于H3O+中O与H+形成了配位键,氧原子单独提供电子对成键,照样符合共价键的饱和性,故B错误;
C.H2分子中H原子的s轨道为球形,无方向性,所以形成的s-s键没有方向性,故C错误;
D.共价键形成时,两个参与成键的原子轨道总是尽可能沿着电子出现概率最大的方向重叠,所以两原子轨道发生重叠后,电子在两核间出现的概率增大,故D错误.
故选A.
点评 本题考查共价键的形成及类型,把握共价键的方向性和饱和性为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
5.氟、氯、溴、碘四种元素,下列有关它们的性质递变规律的说法不正确的是( )
| A. | 单质的密度依次增大 | B. | 单质的熔点和沸点依次升高 | ||
| C. | Cl2可以从KI溶液中置换出I2 | D. | Br2可以从NaCl溶液中置换出Cl2 |
12.下列不属于配合物的是( )
| A. | [Ag(NH3)2]Cl | B. | Na2CO3•10H2O | C. | CuSO4•5H2O | D. | Co(NH3)6Cl3 |
9.下列事实,不能用勒夏特列原理解释的是( )
| A. | 溴水中有平衡:Br2+H2O?HBr+HBrO 加入AgNO3溶液后,溶液颜色变浅 | |
| B. | 合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施 | |
| C. | 高压比常压有利于合成SO3的反应 | |
| D. | 对CO(g)+NO2(g)?CO2(g)+NO(g) 平衡体系增大压强可使颜色变深 |
6.下列有机物命名正确的是( )
| A. | 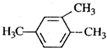 1,3,4-三甲基苯 1,3,4-三甲基苯 | B. | 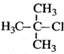 2-甲基-1-氯丙烷 2-甲基-1-氯丙烷 | ||
| C. | 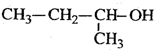 2-甲基-1-丙醇 2-甲基-1-丙醇 | D. | 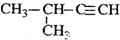 2-甲基-3-丁炔 2-甲基-3-丁炔 |
7.已知位于第4周期的A、B两元素,A原子的M层电子数比B原子的M层电子数少7个.下列说法正确的是( )
| A. | A原子的N层电子数比B原子的N层电子数一定少 | |
| B. | A原子的外围电子数比B原子的外围电子数可能多 | |
| C. | A元素一定是副族元素,B元素可能是副族元素,也可能是主族元素 | |
| D. | A元素一定是副族元素,B元素一定是主族元素 |
 ,属于取代反应.
,属于取代反应.