题目内容
【题目】硫代硫酸钠(Na2S2O3)是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
I.【查阅资料】
①硫代硫酸钠(Na2S2O3)易溶于水,在中性或碱性环境中稳定,受热、遇酸易分解。
②Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
③向Na2CO3和Na2S混合溶液中通人SO2可制得Na2S2O3(反应方程式为:![]() ,所得产品常含有少量Na2SO3和Na2SO4。
,所得产品常含有少量Na2SO3和Na2SO4。
Ⅱ.【制备产品】实验装置如图所示:
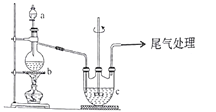
(1)实验步骤:检查装置气密性后,向三颈瓶c中加人Na2CO3和Na2S的混舍溶液,再将分液漏斗a中液体滴加到烧瓶b中加热发生反应产生SO2,请写出b中发生反应的化学方程式________。待Na2S和Na2CO3完全消耗后,结束反应。过滤c中的混合物,滤液经____(填操作名称)、过滤、洗涤、干燥、得到产品。
(2)为了保证硫代硫酸钠的产量,实验中通人的SO2不能过量,原因是_________。
III.【测定产品纯度】
称取10g产品(Na2S2O3·5H2O),配成250mL溶液,取25mL,以淀粉作指示剂,用0.1000mol/L碘的标准溶液滴定。反应原理为:![]() (忽略Na2SO3与I2反应)。
(忽略Na2SO3与I2反应)。
(3)滴定至终点的现象为:____。
(4)重复三次的实验数据如左下表所示,其中第三次读数时滴定管中起始和终点的液面位置如右下图所示,则x=___mL,产品的纯度为____。

IV.【探究与反思】
(5)为验证产品中含有Na2SO3和Na2SO4该小组设计了以下实验方案,请将方案补充完整(所需试剂从稀HN03、稀H2SO4、稀盐酸、蒸馏水中选择):取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,____,则可确定产品中含有Na2SO3和Na2SO4。
【答案】 Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O(或Na2SO3+H2SO4(浓)
CuSO4+SO2↑+2H2O(或Na2SO3+H2SO4(浓)![]() Na2SO4+SO2↑+H2O) 蒸发浓缩、冷却结晶 硫代硫酸钠在酸性条件下会发生水解,二氧化硫过量会使溶液呈酸性,导致产品产量减少 溶液由无色变为蓝色 18.20 99.2% 把所得沉淀,过滤、洗涤后,再加入足量稀盐酸,若沉淀部分溶解,并有刺激性气味的气体生成
Na2SO4+SO2↑+H2O) 蒸发浓缩、冷却结晶 硫代硫酸钠在酸性条件下会发生水解,二氧化硫过量会使溶液呈酸性,导致产品产量减少 溶液由无色变为蓝色 18.20 99.2% 把所得沉淀,过滤、洗涤后,再加入足量稀盐酸,若沉淀部分溶解,并有刺激性气味的气体生成
【解析】(1)制取二氧化硫的反应有多种,可以用Cu与浓硫酸反应加热制取,也可以用亚硫酸钠与浓硫酸不加热制取,所以化学方程式为Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O(或Na2SO3+H2SO4(浓)
CuSO4+SO2↑+2H2O(或Na2SO3+H2SO4(浓)![]() Na2SO4+SO2↑+H2O);过滤c中的混合物,得Na2S2O3溶液,经蒸发浓缩、冷却结晶后,再过滤、洗涤、干燥、得到产品;(2)根据所给资料可知,硫代硫酸钠在酸性条件下会发生分解,二氧化硫过量会使溶液呈酸性,导致产品产量减少,所以二氧化硫不能过量;(3)滴定所用指示剂是淀粉溶液,当达到滴定终点时,碘稍过量,碘遇淀粉变蓝色;所以溶液会由无色变为蓝色;(4)由滴定管的读数可知,开始的刻度是0.50mL,后来的读数是18.70mL,所用溶液的体积是18.20mL,即x=18.20mL,数据相差较大,舍去,则消耗标准液的平均体积为20.00mL,则碘的物质的量是0.0200L×0.1000mol/L,根据碘与硫代硫酸钠反应的方程式可知硫代硫酸钠的物质的量是0.0200L×0.1000mol/L×2×10=0.04mol,所以产品的纯度为
Na2SO4+SO2↑+H2O);过滤c中的混合物,得Na2S2O3溶液,经蒸发浓缩、冷却结晶后,再过滤、洗涤、干燥、得到产品;(2)根据所给资料可知,硫代硫酸钠在酸性条件下会发生分解,二氧化硫过量会使溶液呈酸性,导致产品产量减少,所以二氧化硫不能过量;(3)滴定所用指示剂是淀粉溶液,当达到滴定终点时,碘稍过量,碘遇淀粉变蓝色;所以溶液会由无色变为蓝色;(4)由滴定管的读数可知,开始的刻度是0.50mL,后来的读数是18.70mL,所用溶液的体积是18.20mL,即x=18.20mL,数据相差较大,舍去,则消耗标准液的平均体积为20.00mL,则碘的物质的量是0.0200L×0.1000mol/L,根据碘与硫代硫酸钠反应的方程式可知硫代硫酸钠的物质的量是0.0200L×0.1000mol/L×2×10=0.04mol,所以产品的纯度为![]() ×100%=99.2%;(5)证明硫酸钠、亚硫酸钠的存在,加入氯化钡溶液后,把所得沉淀,过滤、洗涤后,再加入足量稀盐酸,若沉淀部分溶解,并有刺激性气味的气体生成,说明产品中含有硫酸钠和亚硫酸钠。
×100%=99.2%;(5)证明硫酸钠、亚硫酸钠的存在,加入氯化钡溶液后,把所得沉淀,过滤、洗涤后,再加入足量稀盐酸,若沉淀部分溶解,并有刺激性气味的气体生成,说明产品中含有硫酸钠和亚硫酸钠。

 字词句段篇系列答案
字词句段篇系列答案【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2 ![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。有关说法正确的是( )
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。有关说法正确的是( )
组别 | 温度 | 时间/min n/mol | 0 | 10 | 20[] | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15[] |
A. 组别①中,0~20min内,NO2的降解速率为0.0125 mol·L-1·min-1
B. 由实验数据可知实验控制的温度T1<T2
C. 40min时,表格中T2应填的数据为0.18
D. 0~10min内,CH4的降解速率①>②