题目内容
有一变质的Na2SO3样品,经测定还含有5.3%的Na2CO3。称取20g试样,加入4mol/L的盐酸300mL,产生的气体经干燥后其体积为2464mL(标准状况)。试求试样中Na2SO3的质量分数是多少?
答案:
解析:
提示:
解析:
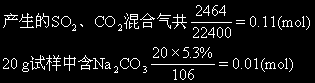
根据Na2CO3+2HCl=2NaCl+H2O+CO2↑ 可知生成的CO2气为0.01mol, 则生成的SO2为0.11-0.01=0.1(mol) 根据Na2SO3+2HCl=2NaCl+H2O+SO2↑ 可知生成0.1molSO2需0.1molNa2SO3,即20g试样中含Na2SO30.1mol,质量为126×0.1=12.6(g)
|
提示:
| 20g该试样中除含有Na2SO3、Na2CO3外,还含有因变质而生成的Na2SO4。加入盐酸的量应为过量,所以4mol/L、300mL与计算无关。Na2SO4与盐酸不反应,Na2SO3、Na2CO3与盐酸反应分别生成SO2、CO2,生成的2464mL气体为SO2和CO2的混合气。再根据有关化学方程式进行求算
|

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
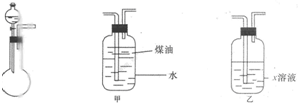 (2010?大连二模)有一化学样品Na2SO3,可能含有NaCl、Na2SO4、KNO3、K2CO2、K2SO4中的一种或几种杂质,某实验小组利用图提供的装置确定该样品的成分及Na2SO3的质量分数.称此样品6.30g,加入6.0mol?L-1的硫酸至过量,产生无色气体560mL(标准状况),向逸出气体后的溶液中加入稍过量的BaCl2溶液,得到白色沉淀9.32g,透过蓝色钻玻璃观察,滤液的焰色反应无紫色.请回答下列问题:
(2010?大连二模)有一化学样品Na2SO3,可能含有NaCl、Na2SO4、KNO3、K2CO2、K2SO4中的一种或几种杂质,某实验小组利用图提供的装置确定该样品的成分及Na2SO3的质量分数.称此样品6.30g,加入6.0mol?L-1的硫酸至过量,产生无色气体560mL(标准状况),向逸出气体后的溶液中加入稍过量的BaCl2溶液,得到白色沉淀9.32g,透过蓝色钻玻璃观察,滤液的焰色反应无紫色.请回答下列问题: