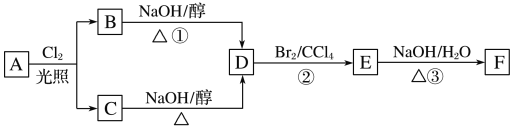
题目内容
【题目】研究NO的性质对建设美丽家乡,打造宜居环境具有重要意义。
(1)自然界在闪电时,生成NO的反应方程式为__________________。
(2)T℃时在容积为2L的恒容密闭容器中,充入NO和O2发生反应:2NO(g)+O2(g)2NO2(g),不同时刻测得容器中n(NO)、n(O2)如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 1 | 0.6 | 0.4 | 0.2 | 0.2 | 0.2 |
n(O2)/mol | 0.6 | 0.4 | 0.3 | 0.2 | 0.2 | 0.2 |
①在T℃下,0~2s时,该反应的平均反应速率![]() =________;
=________;
②该温度下反应的平衡常数K=________,在T℃下,能提高NO的平衡转化率的措施有_______、________。
(3)已知NO和O2反应的历程如图,回答下列问题:
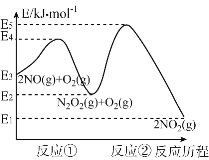
①写出其中反应①的热化学方程式也(△H用含物理量E的等式表示):________。
②试分析上述基元反应中,反应①和反应②的速率较小的是_____(选填“反应①”或“反应②”);已知反应①会快速建立平衡状态,反应②可近似认为不影响反应①的平衡。对该反应体系升高温度,发现总反应速率变慢,其原因可能是____________。
【答案】N2+O2![]() 2NO 0.15mol·L-1·s-1 160.0L·mol-1 增大O2的浓度 增大体系压强 2NO(g)
2NO 0.15mol·L-1·s-1 160.0L·mol-1 增大O2的浓度 增大体系压强 2NO(g)![]() N2O2(g) △H=-(E3-E2)kJ·mol-1 反应② 因为反应①为放热反应,升高温度,反应①平衡逆向移动,导致c(N2O2)减小,反应②变慢,而反应②为慢反应是总反应速率的决速反应
N2O2(g) △H=-(E3-E2)kJ·mol-1 反应② 因为反应①为放热反应,升高温度,反应①平衡逆向移动,导致c(N2O2)减小,反应②变慢,而反应②为慢反应是总反应速率的决速反应
【解析】
(2)根据![]() 计算化学反应速率;根据
计算化学反应速率;根据![]() 求算平衡常数;
求算平衡常数;
(3)根据△H=生成物的总能量-反应物的总能量求算△H;
(4)一般来说,活化能越大,化学反应速率越慢。
(1)在闪电时,N2和O2会发生化合反应生成NO,化学方程式为N2+O2![]() 2NO;
2NO;
(2)①在T℃下,0~2s时,n(NO)从1mol降低到0.4mol,变化了0.6mol,容器体积为2L。根据![]() ,带入数据,有
,带入数据,有![]() ;
;
②根据方程式,从开始到平衡,消耗n(NO)=1mol-0.2mol=0.8mol,则生成n(NO2)=0.8mol。平衡时,NO、O2、NO2的物质的量分别为0.2mol、0.2mol、0.8mol,容器体积为2L,平衡常数![]() ,带入数据,有
,带入数据,有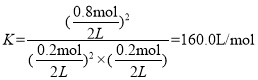 ;
;
在T℃下,提高NO的转化率,需平衡向正反应方向移动,需要注意的是,温度已经限定,不能改变温度。则增大NO的转化率,可以增大O2的浓度;该反应是气体分子数减小的反应,可以压缩体积,增大压强;
(3)①根据图像,反应①为NO(g)反应化合生成N2O2(g),根据△H=生成物的能量-反应物的能量,则热化学方程式:2NO(g)![]() N2O2(g) △H=-(E3-E2)kJ·mol-1;
N2O2(g) △H=-(E3-E2)kJ·mol-1;
②一般来说,活化能越大,化学反应速率越慢。反应①的活化能为E4-E3,反应②的活化能为E5-E2,根据图示,反应②的活化能大,化学反应速率较小;
化学反应速率慢的基元反应是总反应的决速步,反应②的活化能大,化学反应速率较小,是总反应的决速步。从图示看,反应①和②都是放热反应,升高温度,平衡均逆向移动,由于反应①快速达到平衡,则反应①的产物N2O2的浓度会减小,但对于反应②来说,c(N2O2)减小,会使得反应②的反应速率减小,而反应②是总反应的决速步,因此总反应速率变慢。答案:因为反应①为放热反应,升高温度,反应①平衡逆向移动,导致c(N2O2)减小,反应②变慢,而反应②为慢反应是总反应速率的决速反应。

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
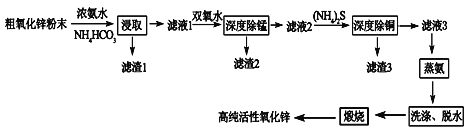
新黄冈兵法密卷系列答案【题目】活性氧化锌(ZnO)广泛用于橡胶、涂料、陶瓷、电子等行业,以粗氧化锌(主要成分为ZnO,还含有少量MnO、CuO、FeO、Fe2O3等)为原料经深度净化可制备高纯活性氧化锌,其流程如图所示:
几种难溶物的Ksp:
物质 | Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | ZnS | CuS |
Ksp | 1.9×10-13 | 8.0×10-16 | 4.0×10-38 | 2.5×10-22 | 6.4×10-36 |
(1)将大小为66nm的高纯活性氧化锌粉末分散到水中,所得分散系为______。
(2)“浸取”过程中ZnO与NH3·H2O、NH4HCO3反应生成可溶性的Zn[(NH3)n]CO3和H2O。若有1mol ZnO溶解,则在该转化反应中参加反应的NH3·H2O和NH4HCO3物质的量之比的最大值为___________(已知:1≤n≤4)。
(3)“深度除锰”过程中双氧水可将“滤液1”中的Mn(OH)2转化为更难溶的MnO2·H2O,写出反应的化学方程式______________,“滤渣2”中存在的物质除了MnO2·H2O还可能含有_________(用化学式表示)。
(4)“深度除铜”过程中当溶液中![]() ≤2.0×10-6时,才能满足“深度除铜”的要求,若溶液中Zn2+浓度为1mol/L时,则最终溶液中S2-的浓度理论上的最小值为____mol/L。
≤2.0×10-6时,才能满足“深度除铜”的要求,若溶液中Zn2+浓度为1mol/L时,则最终溶液中S2-的浓度理论上的最小值为____mol/L。
(5)“蒸氨”过程中Zn[(NH3)n]CO3分解为ZnCO3·2Zn(OH)2·H2O、NH3和CO2。为了提高经济效益,请设计循环利用NH3和CO2方案_____________。
(6)“煅烧”时ZnCO3·2Zn(OH)2转变为高纯活性氧化锌,写出反应的化学方程式______