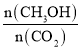题目内容
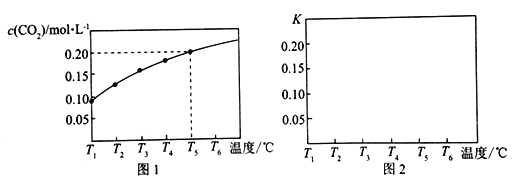
【题目】在一个体积为5 L的真空密闭容器中加入1.25 mol CaCO3,发生反应CaCO3 (s)![]() CaO(s) +CO2(g),测得平衡时二氧化碳的物质的量浓度随温度的变化关系如图所示:
CaO(s) +CO2(g),测得平衡时二氧化碳的物质的量浓度随温度的变化关系如图所示:
请按要求回答下列问题:
(1)该反应正反应为__________热反应(填“吸”或“放”),温度为T5℃时,该反应耗时40s达到平衡,则T5℃时,该反应的平均反应速率为________________。
(2)T2℃时,该反应已经达到平衡,下列措施中能使该反应的平衡常数K值变大的是_______________(选填编号)。
a.减小压强 b.减少CaO的量 c.加入CaCO3 d.升高温度
(3)请在如图中画出平衡常数K随温度的变化曲线_______________。
(4)在T5℃下,维持温度和容器体积不变,向上述平衡体系中再充入1molN2,则最后平衡时容器中的CaCO3的质量为________g。
【答案】 吸 0.005 mol. L-1 s-1 d  25
25
【解析】1)温度越高,二氧化碳的物质的量浓度越大,此反应为吸热反应,T5℃时二氧化碳的物质的量浓度为0.2mol/L,v(CO2)=c(CO2)/△t=0.2mol/L/40s=0.005mol/(Ls);(2)CaCO3 (s)![]() CaO(s) +CO2(g),此反应特点为吸热的反应,K只与温度有关,升高温度,平衡右移,K值增大,答案选d;(3)温度越高,平衡常数越大,且平衡常数即为二氧化碳的浓度,故图象走势为上升,如图为
CaO(s) +CO2(g),此反应特点为吸热的反应,K只与温度有关,升高温度,平衡右移,K值增大,答案选d;(3)温度越高,平衡常数越大,且平衡常数即为二氧化碳的浓度,故图象走势为上升,如图为 ;(4)维持温度和容器体积不变,向上述平衡体系中再充入1molN2,对此平衡无影响,故生成二氧化碳的浓度仍然为0.2mol/L,体积为5L,那么物质的量为5L×0.2mol/L=1mol,依据反应:
;(4)维持温度和容器体积不变,向上述平衡体系中再充入1molN2,对此平衡无影响,故生成二氧化碳的浓度仍然为0.2mol/L,体积为5L,那么物质的量为5L×0.2mol/L=1mol,依据反应:
CaCO3 (s)![]() CaO(s) +CO2(g)
CaO(s) +CO2(g)
100 44
x 44g
解x=100g,那么剩余碳酸钙质量为125g-100g=25g。

 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案