题目内容
为除去粗盐中的Ca2+、Mg2+、Fe3+、称取![]()
![]() 精盐
精盐
(1)判断BaCl2已过量的方法是____________________________________________________。
(2)第④步中,相关的离子方程式是_____________________________________________。
(3)若先用盐酸调pH再过滤,将对实验结果产生影响,其原因是_____________________。
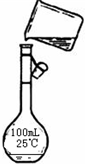
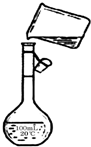
(4)为检验精盐纯度,需配制150 mL 0.2 mol·L-1 NaCl(精盐)溶液,下图是该同学转移溶液的示意图,图中的错误是_________________________________________________。

解析:本实验的目的是除去粗盐中的泥沙、Ca2+、Mg2+、Fe3+、![]() ,从而得到精盐。首先分析每一步实验操作的目的和作用;①是溶解,其目的是将粗盐中可溶物质溶于水中,形成溶液,便于所加试剂与这些杂质离子发生反应,同时也使泥沙沉降;②是加入BaCl2,其目的是让Ba2+与
,从而得到精盐。首先分析每一步实验操作的目的和作用;①是溶解,其目的是将粗盐中可溶物质溶于水中,形成溶液,便于所加试剂与这些杂质离子发生反应,同时也使泥沙沉降;②是加入BaCl2,其目的是让Ba2+与![]() 反应生成BaSO4沉淀使
反应生成BaSO4沉淀使![]() 除去;③是加入NaOH,其目的是与Mg2+、Fe3+反应生成Mg(OH)2和Fe(OH)3沉淀使其除去;④是加入Na2CO3溶液,其目的是将Ca2+、Ba2+转化为CaCO3、BaCO3沉淀使其除去;⑤是过滤,其目的是将泥沙及所生成的难溶物(各种沉淀)除去;⑥是加入适量的盐酸,其目的是除去多余的NaOH和Na2CO3;⑦是蒸发、结晶、烘干,其目的是除去NaCl中的水及少量多余的盐酸,最后得到精盐。
除去;③是加入NaOH,其目的是与Mg2+、Fe3+反应生成Mg(OH)2和Fe(OH)3沉淀使其除去;④是加入Na2CO3溶液,其目的是将Ca2+、Ba2+转化为CaCO3、BaCO3沉淀使其除去;⑤是过滤,其目的是将泥沙及所生成的难溶物(各种沉淀)除去;⑥是加入适量的盐酸,其目的是除去多余的NaOH和Na2CO3;⑦是蒸发、结晶、烘干,其目的是除去NaCl中的水及少量多余的盐酸,最后得到精盐。
(1)判断BaCl2已过量的方法可通过步骤②后的溶液中是否有Ba2+或![]() 来实现。
来实现。
(2)第④步是Na2CO3与Ca2+和Ba2+反应,其离子方程式为:Ca2++![]()
![]() CaCO3↓;Ba2++
CaCO3↓;Ba2++![]()
![]() BaCO3↓。
BaCO3↓。
(3)因生成的沉淀物质都能与盐酸反应,所以应先过滤除去这些沉淀,然后再加入适量盐酸酸化。
(4)配制一定物质的量浓度的溶液一定要按规范操作。题目要求是配制150 mL 0.2 mol·L-1 NaCl溶液,应该用容积为150 mL的容量瓶来配制,且转移液体时一定要用玻璃棒进行引流。
答案:(1)取第②步后的上层清液1—2滴于点滴板上,再滴入1—2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量
(2)Ca2++![]()
![]() CaCO3↓;Ba2++
CaCO3↓;Ba2++![]()
![]() BaCO3↓
BaCO3↓
(3)在此酸度条件下,会有部分沉淀溶解,从而影响制得精盐的纯度
(4)未用玻璃棒引流;未采用150 mL容量瓶



 为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
为除去粗盐中的Ca2+、Mg2+、Fe3+、SO42-以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):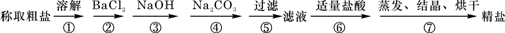

 aOH溶液 b、KOH溶液 c、BaCl2溶液 d、Ba(NO3)2溶液
aOH溶液 b、KOH溶液 c、BaCl2溶液 d、Ba(NO3)2溶液