题目内容
8.Al、Fe、Cu都是重要的金属元素.下列说法正确的是( )| A. | 三者对应的氧化物均能溶于水 | |
| B. | 三者的单质放置在空气中均只生成氧化物 | |
| C. | 制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 | |
| D. | 电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al |
分析 A.依据氧化铝、氧化铜、氧化铜水溶性解答;
B.根据Al、Fe、Cu三者放在空气中所发生的反应来回答;
C.氯化铝、氯化铁和氯化铜都是强酸弱碱盐易水解;
D.根据电解原理,阴极上析出的金属应按照其对应的阳离子的放电顺序来析出;
解答 解:A.氧化铝、氧化铜、氧化铜都不溶于水,故A错误;
B.Fe还可以形成复杂的氢氧化物,Cu可以形成碱式碳酸铜等,故B错误;
C.因为AlCl3、FeCl3、CuCl2的溶液加热时都水解生成沉淀和HCl气体了,HCl挥发了,所以得到的是各自的沉淀物,制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法,故C正确;
D.根据电解原理,阴极上离子的放电顺序是:Cu2+>H+>Fe2+>Al3+,Fe2+和Al3+不放电,Fe3+得电子成为Fe2+,不会析出铁,所以铁和Al不可以析出,因为它们比H活泼,只有Cu可以,故D错误;
故选:C.
点评 本题考查 了金属及其化合物的性质,熟悉常见的金属单质的性质、电解原理以及盐类水解的应用是解题关键,题目难度中等.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
18.有机物M的结构简式如图所示,有关M的说法错误的是( )
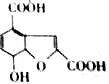

| A. | M的分子式为C18H8O8 | |
| B. | 1molM最多可与3molNa反应 | |
| C. | 一个M分子中含有一个苯环和两个羧基 | |
| D. | M可发生酯化反应,氧化反应 |
19.下列物质与苯互为同系物的是( )
| A. |  | B. |  | C. |  | D. |  |
16.根据下表提供的主要仪器和所用试剂能够实现实验目的是( )
| 选项 | 实验目的 | 主要仪器 | 试剂 |
| A | 分离苯和乙酸的混合物 | 分液漏斗、烧杯 | |
| B | 鉴别葡萄糖和乙酸甲酯 | 试管、烧杯、酒精灯 | 葡萄糖溶液、乙酸甲酯溶液、银氨溶液 |
| C | 实验室制取CO2 | 试管、带导管的橡胶塞 | 大理石、稀硫酸 |
| D | 测定未知NaOH溶液浓度 | 酸、碱式滴定管、锥形瓶、烧杯 | NaOH溶液、0.1mol/L盐酸标准液 |
| A. | A | B. | B | C. | C | D. | D |
13.以结构式表示的下列各物质中,属于烷烃的是( )
| A. |  | B. |  | C. |  | D. |  |
20.某同学欲在实验室中对Fe3+与I-的反应进行探究,实现Fe2+与Fe3+的相互转化.
(1)该同学最初的实验操作和现象如下:
①实验Ⅰ的现象是滴加KSCN后溶液无明显变化,加入氯水后溶液变成红色.
②FeCl2溶液与新制氯水反应的离子方程式为2Fe2++Cl2═2Fe3++2Cl-.
(2)该同学分析了导致实验Ⅱ现象的可能原因,并对实验方案进行了改进.改进后的实验操作和现象如下:
根据实验III,甲同学认为Fe3+有可能与I-发生氧化还原反应,请结合实验现象用简明的文字说明他得出上述结论的理由溶液变成黄色,推测生成了I2
(3)该同学认为需要进一步设计实验证明根据实验Ⅲ中现象得出的结论.请补全下表中的实验方案.
(4)上述实验结果表明,Fe3+能与I-发生氧化还原反应;进一步查阅资料知,参加反应的Fe3+与I-的物质的量相同.该同学结合上述实验结论,分析了实验Ⅲ中加入KSCN后溶液变红的原因,认为Fe3+与I-反应的离子方程式应为2Fe3++2I-?2Fe2++I2.
(1)该同学最初的实验操作和现象如下:
| 编号 | 操作 | 现象 |
| Ⅰ | 向2 mL 0.1 mol/LFeCl2溶液中滴加KSCN溶液,再滴加氯水 | |
| Ⅱ | 向2 mL 0.1 mol/L FeCl3溶液中滴加KSCN溶液,再滴加0.1 mol/L KI溶液 | 滴加KSCN溶液后,溶液变成红色; 滴加KI溶液后,红色无明显变化 |
②FeCl2溶液与新制氯水反应的离子方程式为2Fe2++Cl2═2Fe3++2Cl-.
(2)该同学分析了导致实验Ⅱ现象的可能原因,并对实验方案进行了改进.改进后的实验操作和现象如下:
| 编号 | 操作 | 现象 |
| Ⅲ | 向2 mL 0.1 mol/L KI溶液中滴加1 mL 0.1 mol/L FeCl3溶液,再滴加KSCN溶液 | 滴加FeCl3溶液后,溶液变成黄色; 滴加KSCN溶液后,溶液变成红色 |
(3)该同学认为需要进一步设计实验证明根据实验Ⅲ中现象得出的结论.请补全下表中的实验方案.
| 编号 | 操作 | 预期现象及结论 |
| Ⅳ | 向2 mL 0.1 mol/L KI溶液中滴加 1 mL 0.1mol/L FeCl3溶液,或CCl4;或铁氰化钾溶液 | 溶液变蓝(或溶液分层,下层溶液为紫色;或生成蓝色沉淀),结论:Fe3+能与I-发生氧化还原反应,生成I2(或Fe2+) |
17.在25℃时,某氯化铵溶液的pH=4,下列说法中不正确的是( )
| A. | 溶液中c(H+)>c(OH-),且Kw=c(H+).c(OH-)=1×10-14mol2/L2 | |
| B. | 由水电离出来的H+浓度为1×10-14mol/L-1 | |
| C. | 溶液中c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | 此溶液中由水电离出来的c(H+)=c(OH-) |
18.配制80mL 1mol/L的NaCl溶液,所用容量瓶体积最合适的是( )
| A. | 80mL | B. | 100mL | C. | 250mL | D. | 1000mL |