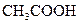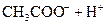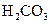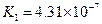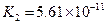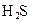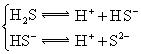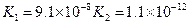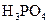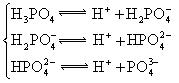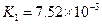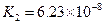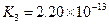题目内容
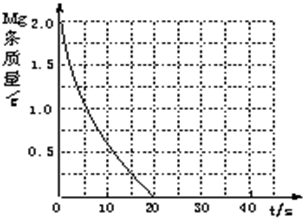
某温度下, pH值相同的盐酸和氯化铵溶液分别稀释,平衡pH值随溶液体积变化的曲线如下图所示。据图判断下列叙述中,正确的是

- A.Ⅱ为氯化铵稀释时pH值变化曲线,a点水的电离程度大于c点水的电离程度
- B.b点溶液中水的电离程度比c点溶液中水的电离程度大,且两点的KW相同
- C.a点时,等体积的两溶液与NaOH反应消耗的NaOH量相同
- D.加入足量NaOH,b点溶液消耗的NaOH比d点溶液消耗的多
A
试题分析:盐酸是强酸,完全电离。氯化铵溶于水,NH4+水解,溶液显酸性,水解方程式是NH4++H2O NH3·H2O+H+。稀释促进水解,氢离子的物质的量增加,氢离子的浓度还是减小的,但氢离子浓度的变化量要小于盐酸中氢离子浓度的变化量。所以曲线Ⅱ为氯化铵稀释时pH值变化曲线,a点水的电离程度大于c点水的电离程度,A正确;曲线I表示盐酸稀释时pH值变化曲线。盐酸是强酸,抑制水的电离,氯化铯水解促进水的电离,则b点溶液中水的电离程度比c点溶液中水的电离程度小,B不正确;a点时,等体积的两溶液与NaOH反应消耗的NaOH量不相同,氯化铵消耗的多,C不正确;b、d两点氯化氢的物质的量相等,所以加入足量NaOH,b点溶液消耗的NaOH和d点溶液消耗的氢氧化钠一样多,D不正确,答案选A。
NH3·H2O+H+。稀释促进水解,氢离子的物质的量增加,氢离子的浓度还是减小的,但氢离子浓度的变化量要小于盐酸中氢离子浓度的变化量。所以曲线Ⅱ为氯化铵稀释时pH值变化曲线,a点水的电离程度大于c点水的电离程度,A正确;曲线I表示盐酸稀释时pH值变化曲线。盐酸是强酸,抑制水的电离,氯化铯水解促进水的电离,则b点溶液中水的电离程度比c点溶液中水的电离程度小,B不正确;a点时,等体积的两溶液与NaOH反应消耗的NaOH量不相同,氯化铵消耗的多,C不正确;b、d两点氯化氢的物质的量相等,所以加入足量NaOH,b点溶液消耗的NaOH和d点溶液消耗的氢氧化钠一样多,D不正确,答案选A。
考点:考查盐类水解、弱电解质的电离、酸碱中和以及水的离子积常数的判断等
试题分析:盐酸是强酸,完全电离。氯化铵溶于水,NH4+水解,溶液显酸性,水解方程式是NH4++H2O
 NH3·H2O+H+。稀释促进水解,氢离子的物质的量增加,氢离子的浓度还是减小的,但氢离子浓度的变化量要小于盐酸中氢离子浓度的变化量。所以曲线Ⅱ为氯化铵稀释时pH值变化曲线,a点水的电离程度大于c点水的电离程度,A正确;曲线I表示盐酸稀释时pH值变化曲线。盐酸是强酸,抑制水的电离,氯化铯水解促进水的电离,则b点溶液中水的电离程度比c点溶液中水的电离程度小,B不正确;a点时,等体积的两溶液与NaOH反应消耗的NaOH量不相同,氯化铵消耗的多,C不正确;b、d两点氯化氢的物质的量相等,所以加入足量NaOH,b点溶液消耗的NaOH和d点溶液消耗的氢氧化钠一样多,D不正确,答案选A。
NH3·H2O+H+。稀释促进水解,氢离子的物质的量增加,氢离子的浓度还是减小的,但氢离子浓度的变化量要小于盐酸中氢离子浓度的变化量。所以曲线Ⅱ为氯化铵稀释时pH值变化曲线,a点水的电离程度大于c点水的电离程度,A正确;曲线I表示盐酸稀释时pH值变化曲线。盐酸是强酸,抑制水的电离,氯化铯水解促进水的电离,则b点溶液中水的电离程度比c点溶液中水的电离程度小,B不正确;a点时,等体积的两溶液与NaOH反应消耗的NaOH量不相同,氯化铵消耗的多,C不正确;b、d两点氯化氢的物质的量相等,所以加入足量NaOH,b点溶液消耗的NaOH和d点溶液消耗的氢氧化钠一样多,D不正确,答案选A。考点:考查盐类水解、弱电解质的电离、酸碱中和以及水的离子积常数的判断等

练习册系列答案
相关题目
对于弱酸,在一定温度下达到电离平衡时,各微粒的浓度存在一种定量的关系.下表是25℃时几种常见弱酸的电离平衡常数
| 酸 | 电离方程式 | 电离平衡常数K |
| | | |
| | | |
| | | |
| | | |
回答下列各问:
(1)K只与温度有关,当温度升高时,K值________(填“增大”、“减小”、“不变”).
(2)在温度相同时,各弱酸的K值不同,那么K值的大小与酸性的相对强弱有何关系?__________________.
(3)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看作是酸,其中酸性最强的是_________,最弱的是________.
(4)多元弱酸是分步电离的,每一步都有相应的电离平衡常数.对于同一种多元弱酸的K1、K2、K3之间存在着数量上的规律,对于H3PO4此规律是________________,产生此规律的原因是_________________________.
![]() (5)电离平衡常数是用实验的方法测定出来的.现已经测得某温度下 NH3∙H2O溶液中存在如下反应:NH3∙H2O NH4++OH- 已知0.10 mol·L-1NH3∙H2O溶液中,达到平衡时,C平衡(OH-)=4.2 × 10-3mol·L-1,C平衡(NH3∙H2O)≈C起始(NH3∙H2O),水的电离可忽略不计;
(5)电离平衡常数是用实验的方法测定出来的.现已经测得某温度下 NH3∙H2O溶液中存在如下反应:NH3∙H2O NH4++OH- 已知0.10 mol·L-1NH3∙H2O溶液中,达到平衡时,C平衡(OH-)=4.2 × 10-3mol·L-1,C平衡(NH3∙H2O)≈C起始(NH3∙H2O),水的电离可忽略不计;
①用pH试纸测量溶液的pH值,即可求得C平衡(OH-),测定溶液pH值的操作是______________。
②测量C平衡(NH3∙H2O)的方法最好用_____________法(填方法名称)
③求此温度下该反应的平衡常数K.(写出计算过程,计算结果保留2位有效数字)