题目内容
【题目】部分氧化的铁铜合金样品(氧化产物为Fe2O3、CuO)共5.76g,经如图处理:

(1)滤渣成分为__,滤液A中含有的阳离子为__。
(2)样品中铁元素的质量分数为__。
【答案】Cu Fe2+、H+ 38.89%
【解析】
样品的成分有Fe、Cu、Fe2O3、CuO,加入足量稀硫酸发生的反应有:①Fe+H2SO4=FeSO4+H2↑ ②Fe2O3+3H2SO4=Fe2(SO4)3+3H2O ③CuO+ H2SO4=CuSO4+H2O ④Fe+ Fe2(SO4)3=3 FeSO4 ⑤ Fe+ CuSO4=Cu+ FeSO4,当稀硫酸足量时,Fe完全反应不剩余。因为氧化性Fe3+
>Cu2+,所以Fe3+反应完以后再发生反应⑤,溶液中的铁元素全部以Fe2+形式存在,稀硫酸足量,溶液中会有大量H+。滤液A经过上述操作得到3.2g固体的过程发生的反应有:FeSO4+2NaOH=Fe(OH)2↓+Na2SO4;4Fe(OH)2+O2+2H2O= 4Fe(OH)3;2Fe(OH)3![]() 3H2O+ Fe2O3;3.2g固体成分是Fe2O3,原样品中的铁元素全部转化到Fe2O3中,则铁元素的质量可求,进而可以求出样品中铁元素的质量分数。
3H2O+ Fe2O3;3.2g固体成分是Fe2O3,原样品中的铁元素全部转化到Fe2O3中,则铁元素的质量可求,进而可以求出样品中铁元素的质量分数。
(1)稀硫酸足量,铁完全反应,滤液A中不含Cu2+,所以滤渣成分是铜。溶液中的铁元素全部以Fe2+形式存在,稀硫酸足量,溶液中还会有H+。
答案为:Cu;Fe2+、H+
(2)原样品中的铁元素全部转化到Fe2O3中,则铁元素的质量为:![]() (g),样品中铁元素的质量分数为:
(g),样品中铁元素的质量分数为:![]() ;
;
答案为:38.89%。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案【题目】硫酸锌是一种重要的工业原料,广泛用于农业、化工、电镀等行业。工业上由锌渣(主要成分为ZnO、FeO、CuO、PbO等)等工业废料生产ZnSO4·7H2O的流程如下:
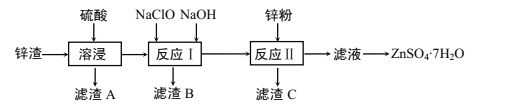
(1)“溶浸”操作中,选用“锌渣”而不选择氧化锌矿粉的原因是______;该操作中不断通入高温水蒸气的目的是________。
(2)“滤渣A”的主要成分是________。
(3)“反应Ⅰ”中,加入NaClO反应的离子方程式为___。
(4)“反应Ⅰ”中,再加入NaOH调节pH约为4.5,则“滤渣B”的主要成分是_____(填化学式)。(Ksp[Zn(OH)2]=3×10-17,Ksp[Cu(OH)2]=2.2×10-20,Ksp[Fe(OH)3]=2.8×10-39)
(5)“反应Ⅱ”中,加入的锌粉需用少量稀硫酸处理,原因是_________。
(6)取28.7gZnSO4·7H2O加热至不同温度,剩余固体的质量如下表:
温度/℃ | 100 | 250 | 680 | 930 |
质量/g | 17.90 | 16.10 | 13.43 | 8.10 |
则680℃时所得固体的化学式为_________(填字母标号)。
A.ZnO B.Zn3O(SO4)2 C.ZnSO4 D.ZnSO4·H2O


