题目内容
3.硫与热的烧碱溶液反应的化学方程式为3S+6NaOH═2Na2S+Na2SO3+3H2O,下列有关叙述正确的是( )| A. | S是氧化剂,NaOH是还原剂 | |
| B. | Na2S是还原产物,H2O是氧化产物 | |
| C. | 氧化剂与还原剂的物质的量之比为1:2 | |
| D. | 氧化剂与还原剂的物质的量之比为2:1 |
分析 3S+6NaOH═2Na2S+Na2SO3+3H2O中,S元素的化合价由0升高为+4价,S元素的化合价由0降低为-2价,以此来解答.
解答 解:3S+6NaOH═2Na2S+Na2SO3+3H2O中,S元素的化合价由0升高为+4价,S元素的化合价由0降低为-2价,
A.S元素的化合价由0升高为+4价,S元素的化合价由0降低为-2价,所以S既是氧化剂又是还原剂,故A错误;
B.该反应中S元素既被氧化又被还原,所以Na2S是还原产物,Na2SO3是氧化产物,故B错误;
C.3molS参加反应,1molS作还原剂,2molS作氧化剂,所以氧化剂与还原剂的物质的量之比为2:1,故C错误;
D.3molS参加反应,1molS作还原剂,2molS作氧化剂,所以氧化剂与还原剂的物质的量之比为2:1,故D正确;
故选:D.
点评 本题考查氧化还原反应,为高考常见题型,侧重氧化还原反应基本概念的考查,把握氧化剂、还原剂的反应及化合价变化即可解答,题目难度不大.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
13.下列物质属于钠盐的是( )
| A. | NaHSO4 | B. | NaOH | C. | Na2O | D. | Na2O2 |
14.将绿矾晶体加强热,除生成水蒸气以外,还发生如下反应:2FeSO 4═Fe2O3+SO2↑+SO3↑. 如将生成的混合气体通过BaCl2溶液,应发生的现象有( )
| A. | 一定产生BaSO4沉淀 | B. | 一定产生BaSO3沉淀 | ||
| C. | 一定没有SO2逸出 | D. | 一定有SO3逸出 |
11.下列说法错误的是( )
| A. | 乙醇和乙酸都是常用调味品的主要成分 | |
| B. | 乙醇和乙酸的沸点和熔点都比C2H6、C2H4的沸点和熔点高 | |
| C. | 乙醇和乙酸都能发生氧化反应 | |
| D. | 乙醇和乙酸之间能发生酯化反应,酯化反应是不可逆反应 |
18.下列关于氯气的说法错误的是( )
| A. | 无色无味 | B. | 有毒 | C. | 密度比空气大 | D. | 单质 |
8.对于如图所示装置的叙述正确的是( )
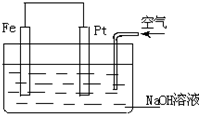

| A. | 这是一个原电池的装置 | |
| B. | 这是电解NaOH溶液的装置 | |
| C. | Pt为正极,其电极反应为:2H++2e-═H2↑ | |
| D. | Fe为负极,其电极反应为:4OH--4e-═2H2O+O2↑ |
15.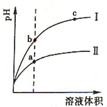 某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,溶液的pH随溶液体积变化的曲线如图所示.下列判断正确的是( )
某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,溶液的pH随溶液体积变化的曲线如图所示.下列判断正确的是( )
 某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,溶液的pH随溶液体积变化的曲线如图所示.下列判断正确的是( )
某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,溶液的pH随溶液体积变化的曲线如图所示.下列判断正确的是( )| A. | Ⅱ为盐酸稀释时的pH变化曲线 | |
| B. | a点Kw的数值比c点Kw的数值大 | |
| C. | b点酸的总浓度大于a点酸的总浓度 | |
| D. | b点溶液的导电性比c点溶液的导电性强 |
12.下列离子的检验不能达到预期目的是( )
| A. | 向待测液里加入NaOH溶液,产生红褐色沉淀,则待测液中肯定含有Fe3+ | |
| B. | 向待测液里加入BaCl2溶液,若产生白色沉淀,再加入过量稀硝酸白色沉淀不溶解,则表明待测液中肯定含有SO42- | |
| C. | 向待测液里加入过量硝酸无现象,再加入硝酸银溶液,若无沉淀生成,则表明待测液中肯定不含Cl- | |
| D. | 向待测液里加入CaCl2溶液,不产生白色沉淀,加入稀盐酸产生无色无味气体,该气体通入澄清石灰水中,溶液变浑浊,则表明待测液中肯定含HCO3- |