题目内容
【题目】溴苯可用作有机溶剂溴苯是制备精细化工品的原料,也是制备农药的基本原料。其制备可采用下列装置:
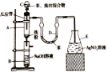
有关数据如下表:
密度(g·cm-3) | 熔点/℃ | 沸点/℃ | 溶解性 | |
溴 | 3.12 | -7.2 | 58.8 | 微溶于水,易溶于乙醇、乙醚、氯仿、四氯化碳等 |
苯 | 0.88 | 5.5 | 80.1 | 不溶于水,易溶于有机溶剂 |
溴苯 | 1.50 | -30.7 | 156.2 | 不溶于水,溶于甲醇、乙醚、苯、四氯化碳等多数有机溶剂 |
有关反应:
(ⅰ)![]() +Br2
+Br2![]()
![]() +HBr(溴苯制备反应)
+HBr(溴苯制备反应)
(ⅱ)![]() +H2O
+H2O![]() +HBr(反应微弱)
+HBr(反应微弱)
实验步骤:
在装置A底部放入少许石棉丝,然后加入2g铁粉;装置C中加入由22.0mL苯和10.0mL液溴混合而成的混合液;其他装置的试剂如图所示;打开装置 C的活塞,使苯、液溴混合液滴到铁粉上;取下装置B,进行下列流程图中的操作,最后得到11.1 mL溴苯。
粗溴苯与

回答下列问题:
(1)装置A中的铁粉可以用___________(填试剂的化学式)代替,原因是___________。
(2)装置B中的NaOH的作用是_____________________。
(3)装置D中苯的作用是___________。
(4)分离Ⅰ、分离Ⅱ、分离Ⅲ分别为___________(填标号)。
a.分液、蒸馏、过滤 b.分液、分液、过滤
c.过滤、分液、过滤 d.分液、过滤、过滤
(5)流程图中加入的CaCl2的作用是___________,若实验过程中省略该步操作,实验的产率_________(填“偏高”偏低“或“不变”)。
(6)本实验的产率为___________。
【答案】FeBr3起催化作用的是FeBr3除去溴苯中的Br2除去HBr中的Br2b干燥(或答“除去溴苯中的水分”)偏低0.750或75.0%
【解析】
(1)苯和溴的反应中溴化铁为催化剂,所以铁粉可以用溴化铁代替; (2)反应后容器中有溴,加入氢氧化钠,溴可以和氢氧化钠反应,进而除去溴苯中的Br2;(3)溴可以溶解在苯这种有机溶剂中,所以可以用苯除去HBr中的Br2; (4)溴苯和氢氧化钠是分层的,用分液的方法分离,加水洗涤,在用分液的方法分离,在加入氯化钙吸水,氯化钙不溶于水,不溶于苯,所以用过滤的方法分离,故选b。 (5).加入氯化钙是为了吸水,干燥溴苯;如果省略该不操作,则加热过程中溴苯和水发生微弱反应,所以溴苯的产率偏低;(6)根据铁和溴的反应计算铁消耗的溴的质量,2Fe+3Br2=2FeBr3,消耗的溴的质量为![]() ,仪器中加入的溴的质量为10×3.12=31.2g,则与苯反应的溴的质量为31.2-8.57=22.63g,苯的质量为22×0.88=19.36g,生成的溴苯的质量为11.1×1.5=16.65g,根据方程式计算苯和溴反应中苯过量,用溴计算,则理论上溴苯的质量为
,仪器中加入的溴的质量为10×3.12=31.2g,则与苯反应的溴的质量为31.2-8.57=22.63g,苯的质量为22×0.88=19.36g,生成的溴苯的质量为11.1×1.5=16.65g,根据方程式计算苯和溴反应中苯过量,用溴计算,则理论上溴苯的质量为![]() ,则溴苯的产率为
,则溴苯的产率为![]() ,故答案为:0.750或75.0%。
,故答案为:0.750或75.0%。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案

