题目内容
关于如图所示装置的叙述,正确的是( )
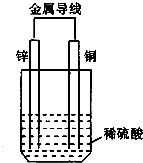

分析:锌、铜和稀硫酸构成的原电池中,锌易失电子发生氧化反应而作负极,铜作正极,正极上氢离子得电子发生还原反应,电子从负极沿导线流向正极.
解答:解:A.锌易失电子生成锌离子而作负极,故A错误;
B.该反应中,锌易失电子而作负极,铜作正极,正极上氢离子得电子生成氢气,所以硫酸根离子不参加反应,则溶液中硫酸根离子的物质的量不变,故B错误;
C.原电池放电时,电解质溶液中阴离子向负极移动,阳离子向正极移动,故C正确;
D.电子从负极锌沿导线流向正极铜,故D错误;
故选C.
B.该反应中,锌易失电子而作负极,铜作正极,正极上氢离子得电子生成氢气,所以硫酸根离子不参加反应,则溶液中硫酸根离子的物质的量不变,故B错误;
C.原电池放电时,电解质溶液中阴离子向负极移动,阳离子向正极移动,故C正确;
D.电子从负极锌沿导线流向正极铜,故D错误;
故选C.
点评:本题考查了原电池原理,根据得失电子确定正负极,知道正负极上电极反应式的书写,注意电解质溶液中阴阳离子的移动方向,为易错点.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案
相关题目
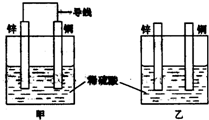 关于如图所示装置的叙述,正确的是( )
关于如图所示装置的叙述,正确的是( )| A、两装置中锌片都发生氧化反应 | B、两装置中溶液的pH均增大 | C、两装置中铜片的质量均逐渐减小 | D、两装置中铜片表面均无气泡产生 |

 关于如图所示装置的叙述正确的是( )
关于如图所示装置的叙述正确的是( )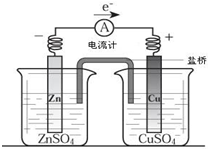 关于如图所示装置的叙述,正确的是( )
关于如图所示装置的叙述,正确的是( )