题目内容
16.莽草酸结构简式如图.下列说法错误的是( )
| A. | 该物质分子式为C7H10O5 | |
| B. | 该物质与乙酸互为同系物 | |
| C. | 该物质能与乙醇发生酯化反应 | |
| D. | 1mol该物质与Na反应时,最多消耗Na 4mol |
分析 有机物中含有羧基,具有酸性,可发生中和、酯化反应,含有羟基,可发生取代、氧化和消去反应,含有碳碳双键,可发生加成、加聚和氧化反应,以此解答该题.
解答 解:A.由结构简式可知该有机物的分子式为C7H10O5,故A正确;
B.有机物含有碳碳双键和多个羟基,与乙酸结构不同,不是同系物,故B错误;
C.含有羧基,可与乙醇发生酯化反应,故C正确;
D.含有3个羟基、1个羧基,都可与钠反应生成氢气,则1mol该物质与Na反应时,最多消耗Na 4mol,故D正确.
故选B.
点评 本题考查有机物的结构与性质,为高频考点,注意把握有机物的官能团及性质的关系,明确醇、烯烃、羧酸的性质即可解答,题目难度不大.

练习册系列答案
 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案
相关题目
6.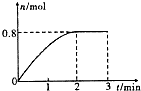 一定条件下,将3molA和l mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?C(g)+2D(s).2min末该反应达到平衡,生成D的物质的量随时间变化情况如图.下列判断正确的是( )
一定条件下,将3molA和l mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?C(g)+2D(s).2min末该反应达到平衡,生成D的物质的量随时间变化情况如图.下列判断正确的是( )
 一定条件下,将3molA和l mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?C(g)+2D(s).2min末该反应达到平衡,生成D的物质的量随时间变化情况如图.下列判断正确的是( )
一定条件下,将3molA和l mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g)+B(g)?C(g)+2D(s).2min末该反应达到平衡,生成D的物质的量随时间变化情况如图.下列判断正确的是( )| A. | 若混合气体的密度不再改变时,该反应不一定达到平衡状态 | |
| B. | 2 min后,加压会使正反应速率加快,逆反应速率变慢,平衡正向移动 | |
| C. | 反应过程中A和B的转化率之比为3:1 | |
| D. | 开始到平衡,用A表示该反应的化学反应速率为0.3mol•L-1•min-1 |
4.NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 1mol铁与足量氯气反应,失去的电子数为2NA | |
| B. | 2 L 0.2 mol•L-1 K2SO4溶液SO42- 物质的量浓度为0.4 mol•L-1 | |
| C. | 在同温同压下,相同体积的任何气体单质所含原子数目相同 | |
| D. | 同温同压下,含NA个分子的二氧化碳气体和含NA个分子的氖气体积相同 |
11.已知:CO(g)+FeO(s)═Fe(s)+CO2(g)△H=-218kJ/mol,则14gCO气体还原足量FeO固体得到Fe固体和CO2气体时放出的热量为( )
| A. | +218kJ/mol | B. | -109kJ/mol | C. | 218kJ | D. | 109kJ |
1.下列说法中正确的是( )
| A. | 氯化钠水溶液在电流的作用下电离出Na+和Cl- | |
| B. | 硫酸钠在水中的电离方程式可表示为Na2SO4═2Na++S6++4O2- | |
| C. | 二氧化碳溶于水能部分电离,故二氧化碳属于弱电解质 | |
| D. | 硫酸钡难溶于水,但硫酸钡属于强电解质 |
5.下列说法错误的是( )
| A. | 增大反应物的浓度,可增大活化分子的百分数,从而使反应速率增大 | |
| B. | 决定化学反应速率的主要因素是参加反应的物质的性质 | |
| C. | NH4HCO3 (s)═NH3 (g)+H2O(g)+CO2(g)△H=+185.57 kJ•mol-1,能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 | |
| D. | 升温能使化学反应速率增大的主要原因是增大了反应物分子中活化分子的百分数 |
6.用下列有关实验装置进行的相应实验,能达到实验目的是( )
| A. |  制取并收集干燥的NH3 | B. |  制取并收集Cl2 | ||
| C. |  检验浓硫酸与蔗糖反应产生的SO2 | D. |  可分离I2和CCl4的混合物 |