МвДҝДЪИЭ
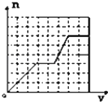
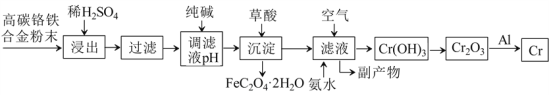
ЎҫМвДҝЎҝёхәПҪрУРЦШТӘөДУГНҫЈ¬ҙУЖд·ПБПЦРЦЖИЎёхөДБчіМИзПВ:
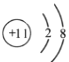
ТСЦӘ: ўЩ Cr+H2SO4=CrSO4+H2ЎьЈ¬
ўЪ БчіМЦРёхФӘЛШҪюіцЦ®әуЦБЙъіЙCr(OH)3Ц®јдҫщТФЧФУЙТЖ¶ҜАлЧУЧҙМ¬ҙжФЪУЪИЬТәЦРЎЈ
Зл»ШҙрПВБРОКМв:
ЈЁ1Ј©ПЎБтЛбЛбҪю№эіМЦРЈ¬МбёЯЎ°ҪюіцВКЎұөДҙлК©УРЈә________________________ (РҙТ»МхјҙҝЙ) ЎЈ
ЈЁ2Ј©УГҙҝјоөчҪЪВЛТәpHЈ¬өГөҪДіИхјоіБөнЈ¬Ифҙҝјо№эБҝЈ¬ФтҝЙДЬөјЦВөДәу№ыКЗ_Јә_____________ЎЈ
ЈЁ3Ј©БчіМЦРөДЎ°ёұІъОпЎұЦРЈ¬ҝЙУГЧчҝЙИЬРФұөСОЦР¶ҫҪв¶ҫјБөДОпЦКөД»ҜС§КҪКЗ___________Ј»ҝЙУГЧч»Ҝ·КөДОпЦКөД»ҜС§КҪКЗ_____________ЎЈ
ЈЁ4Ј©јУИлІЭЛбКөПЦіБөнЧӘ»Ҝ·ҙУҰ»ҜС§·ҪіМКҪОӘЈә_______________________________________ЎЈ
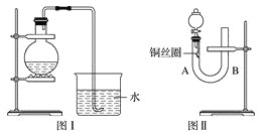
ЈЁ5Ј©БчіМЦРАыУГВБИИ·ҙУҰТұБ¶ёхөД»ҜС§·ҪіМКҪОӘЈә_____________________________________ЎЈ
ЈЁ6Ј©БчіМЦРУЙВЛТәЙъіЙCr(OH)3өД»ҜС§·ҪіМКҪОӘЈә_____________________________________ЎЈ
ЈЁ7Ј©іэТСЦӘ·ҙУҰўЩЦ®НвЈ¬ХыёцБчіМЦРЙжј°өДЦчТӘСх»Ҝ»№Фӯ·ҙУҰУР_____ёцЈ¬·ЦҪв·ҙУҰУР____ёцЎЈ
Ўҫҙр°ёЎҝјУИИЎўҪБ°иЎўККөұМбёЯПЎБтЛбЕЁ¶ИөИ(ҙр°ёәПАнјҙҝЙ) H2C2O4өДПыәДБҝ№эҙуЈЁ»тК№Cr2+ЧӘ»ҜіЙіБөн¶шЛрәДЈ© Na2SO4 (NH4)2SO4 Fe(OH)2+H2C2O4=FeC2O4ЎӨ2H2O Cr2O3+2Al![]() Al2O3+2Cr 4CrSO4+O2+8NH3ЎӨH2O+2H2O=4Cr(OH)3Ўэ+4(NH4)2SO4 3 1
Al2O3+2Cr 4CrSO4+O2+8NH3ЎӨH2O+2H2O=4Cr(OH)3Ўэ+4(NH4)2SO4 3 1
ЎҫҪвОцЎҝ
ёЯМјёхМъәПҪр·ЫД©јУИлПЎH2SO4ҪюИЎЈ¬ЖдЦРCrЎўFeИЬҪвЙъіЙCrSO4ЎўFeSO4Ј»№эВЛәуУГҙҝјоөчҪЪpHК№Fe2+ЧӘ»ҜіЙFeЈЁOHЈ©2іБөнЈ¬ФЩјУИлІЭЛбҪ«FeЈЁOHЈ©2ЧӘ»ҜОӘFeC2O4ЎӨ2H2OіБөн¶шіэИҘЈ»ҙЛКұВЛТәЦРЦчТӘә¬CrSO4әНNa2SO4Ј¬ПтВЛТәЦРНЁИлҝХЖшІўјУИл°ұЛ®Ј¬ВЛТәЦРCr2+ЧӘ»ҜіЙCrЈЁOHЈ©3іБөнЈ¬·ўЙъөД·ҙУҰОӘ4CrSO4+O2+8NH3ЎӨH2O+2H2OЈҪ4CrЈЁOHЈ©3Ўэ+4ЈЁNH4Ј©2SO4Ј¬өГөҪөДёұІъОпЦчТӘә¬ЈЁNH4Ј©2SO4ЎўNa2SO4Ј»CrЈЁOHЈ©3КЬИИ·ЦҪвіЙCr2O3Ј»Cr2O3УлAl·ўЙъВБИИ·ҙУҰЙъіЙCrәНAl2O3Ј¬ҫЭҙЛ·ЦОцЧчҙрЎЈ
ЈЁ1Ј©ёщҫЭНвҪзМхјю¶Ф·ҙУҰЛЩВКөДУ°ПмҝЙЦӘПЎH2SO4ЛбҪю№эіМЦРЈ¬МбёЯЎ°ҪюіцВКЎұөДҙлК©УРЈәјУИИЎўҪБ°иЎўККөұМбёЯПЎH2SO4өДЕЁ¶ИөИЎЈ
ЈЁ2Ј©УГҙҝјоөчҪЪВЛТәpHЈ¬К№Fe2+ЧӘ»ҜіЙFeЈЁOHЈ©2іБөнЈ¬ФЩјУИлІЭЛбҪ«FeЈЁOHЈ©2ЧӘ»ҜОӘFeC2O4ЎӨ2H2OіБөн¶шіэИҘЎЈИфҙҝјо№эБҝЈ¬ҝЙДЬөјЦВөДәу№ыКЗЈәТ»·ҪГжК№Cr2+ЧӘ»ҜіЙіБөн¶шұ»ПыәДЈ¬К№CrөДІъВКҪөөНЈ»БнТ»·ҪГжК№әуРш№эіМЦРH2C2O4өДПыәДБҝ№эҙуЎЈ
ЈЁ3Ј©іэИҘFe2+әуөДВЛТәЦРЦчТӘИЬЦКОӘCrSO4әНNa2SO4Ј¬ПтВЛТәЦРНЁИлҝХЖшІўјУИл°ұЛ®Ј¬ВЛТәЦРCr2+ЧӘ»ҜіЙCrЈЁOHЈ©3іБөнЈ¬өГөҪөДёұІъОпОӘЈЁNH4Ј©2SO4әНNa2SO4Ј¬ЖдЦРҝЙУГЧчҝЙИЬРФұөСОЦР¶ҫҪв¶ҫјБөДОпЦКөД»ҜС§КҪКЗNa2SO4Ј¬Ҫв¶ҫөДФӯАнОӘSO42-+Ba2+=BaSO4ЎэЎЈҝЙУГЧч»Ҝ·КөДОпЦКөД»ҜС§КҪКЗЈЁNH4Ј©2SO4Ј¬ЈЁNH4Ј©2SO4КЗТ»ЦЦөӘ·КЎЈ
ЈЁ4Ј©јУИлІЭЛбҪ«FeЈЁOHЈ©2іБөнЧӘ»ҜОӘFeC2O4ЎӨ2H2OЈ¬іБөнЧӘ»Ҝ·ҙУҰөД»ҜС§·ҪіМКҪОӘFeЈЁOHЈ©2+H2C2O4ЈҪFeC2O4ЎӨ2H2OЎЈ
ЈЁ5Ј©AlУлCr2O3·ўЙъВБИИ·ҙУҰЙъіЙAl2O3әНCrЈ¬·ҙУҰөД»ҜС§·ҪіМКҪОӘ2Al+Cr2O3![]() Al2O3+2CrЎЈЈ©ВЛТәЦРНЁИлҝХЖшЎўјУИл°ұЛ®CrSO4ЧӘ»ҜОӘCrЈЁOHЈ©3іБөнЈ¬1molCr2+К§ИҘ1molөзЧУЙъіЙ1molCrЈЁOHЈ©3Ј¬1molO2өГөҪ4molөзЧУЈ¬ёщҫЭөГК§өзЧУКШәгЎўФӯЧУКШәгЈ¬УЙВЛТәЙъіЙCrЈЁOHЈ©3өД»ҜС§·ҪіМКҪОӘ4CrSO4+O2+8NH3ЎӨH2O+2H2OЈҪ4CrЈЁOHЈ©3Ўэ+4ЈЁNH4Ј©2SO4ЎЈ
Al2O3+2CrЎЈЈ©ВЛТәЦРНЁИлҝХЖшЎўјУИл°ұЛ®CrSO4ЧӘ»ҜОӘCrЈЁOHЈ©3іБөнЈ¬1molCr2+К§ИҘ1molөзЧУЙъіЙ1molCrЈЁOHЈ©3Ј¬1molO2өГөҪ4molөзЧУЈ¬ёщҫЭөГК§өзЧУКШәгЎўФӯЧУКШәгЈ¬УЙВЛТәЙъіЙCrЈЁOHЈ©3өД»ҜС§·ҪіМКҪОӘ4CrSO4+O2+8NH3ЎӨH2O+2H2OЈҪ4CrЈЁOHЈ©3Ўэ+4ЈЁNH4Ј©2SO4ЎЈ
ЈЁ6Ј©іэ·ҙУҰўЩЦ®НвЈ¬ХыёцБчіМЦРЙжј°өДЦчТӘСх»Ҝ»№Фӯ·ҙУҰ»№УРЈәFe+H2SO4ЈҪFeSO4+H2ЎьЎў4CrSO4+O2+8NH3ЎӨH2O+2H2OЈҪ4CrЈЁOHЈ©3Ўэ+4ЈЁNH4Ј©2SO4Ўў2Al+Cr2O3![]() Al2O3+2CrЈ¬јҙСх»Ҝ»№Фӯ·ҙУҰУР3ёцЈ»·ЦҪв·ҙУҰОӘ2CrЈЁOHЈ©3
Al2O3+2CrЈ¬јҙСх»Ҝ»№Фӯ·ҙУҰУР3ёцЈ»·ЦҪв·ҙУҰОӘ2CrЈЁOHЈ©3![]() Cr2O3+3H2OЈ¬јҙ·ЦҪв·ҙУҰУР1ёцЎЈ
Cr2O3+3H2OЈ¬јҙ·ЦҪв·ҙУҰУР1ёцЎЈ