题目内容
16.某14%的KOH溶液加热蒸发掉100g水后,得到28%的KOH溶液80mL,则原溶液的质量为200g,其中溶质的质量为28g,其物质的量为0.5mol,28%的该KOH溶液的物质的量浓度为6.25mol/L.分析 根据蒸发前后溶质的质量不变,据此计算出蒸发前溶液的质量,根据质量分数计算溶质的质量及物质的量,再根据n=$\frac{m}{M}$、c=$\frac{n}{V}$计算蒸发后溶液的物质的量浓度.
解答 解:设14%氢氧化钾溶液的质量为x,蒸发前后溶质的质量不变,则有x×14%=(x-100g)×28%,解得:x=200g;
原溶液中含有溶质的质量为:200g×14%=28g,氢氧化钾的物质的量为:$\frac{28g}{56g/mol}$=0.5mol;
蒸发过程中溶质的物质的量不变,则所得溶液的物质的量浓度为:$\frac{0.5mol}{0.08L}$=6.25mol/L,
故答案为:200g;28g;0.5mol;6.25mol/L.
点评 本题考查了物质的量浓度的简单计算,题目难度不大,注意掌握物质的量浓度的概念及计算方法,明确物质的量与物质的量浓度、摩尔质量之间的关系.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
6.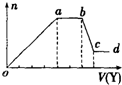 某无色稀溶液X中,可能含有下表所列离子中的某几种.现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示.
某无色稀溶液X中,可能含有下表所列离子中的某几种.现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示.
(1)若Y是盐酸,则X中一定含有的离子是CO32-、SiO32-、AlO2-、Na+,oa段发生反应的离子方程式SiO32-+2H+═H2SiO3↓、AlO2-+H++H2O═Al(OH)3↓,(指来源于X溶液的,下同) ab段发生反应的离子方程式CO32-+H+═HCO3-、HCO3-+H+═H2O+CO2↑,bc段发生反应的离子方程式Al(OH)3+3H+═Al3++3H2O.
(2)若Y是NaOH溶液,则X中一定含有的离子是Al3+、Mg2+、NH4+、Cl-,则oa段转化为沉淀的离子是Al3+、Mg2+,ab段反应的离子方程式为NH4++OH-═MH3•H2O.bc段反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O.
 某无色稀溶液X中,可能含有下表所列离子中的某几种.现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示.
某无色稀溶液X中,可能含有下表所列离子中的某几种.现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系如图所示.| 阴离子 | CO32-、Si32-、AlO2-、Cl- |
| 氧离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
(2)若Y是NaOH溶液,则X中一定含有的离子是Al3+、Mg2+、NH4+、Cl-,则oa段转化为沉淀的离子是Al3+、Mg2+,ab段反应的离子方程式为NH4++OH-═MH3•H2O.bc段反应的离子方程式为Al(OH)3+OH-═AlO2-+2H2O.
7.下列有关实验操作的叙述中,错误的是( )
| A. | 实验室用排水集气法收集氧气完毕,把导管从水中取出,然后移去酒精灯 | |
| B. | 氢气还原氧化铜的实验结束,先移去酒精灯,待试管冷却后再停止通氢气 | |
| C. | 倾倒液体进行过滤时,应使液体沿着玻璃棒流下,且液面低于滤纸边缘 | |
| D. | 因NaOH有腐蚀性,可在天平两托盘上放同样的滤纸后再放NaOH,然后进行称量 |
4.给下列溶液中通入CO2气体,不可能产生沉淀的是( )
| A. | 氯化钙和硝酸钡的混合液 | B. | 稀的水玻璃 | ||
| C. | 偏铝酸钠溶液 | D. | 碳酸钠饱和溶液 |
11.能鉴别CO2和SO2的试剂是( )
| A. | 品红溶液 | B. | 澄清石灰水 | ||
| C. | 紫色石蕊试液 | D. | 氯化钡溶液和氯水 |
8.在标准状况下,H2和Cl2各nL,经混合光照反应后,所得气体恰好使bmolNaOH完全转化为盐,n与b的关系可能是( )
| A. | b=$\frac{n}{22.4}$ | B. | b=$\frac{22.4}{n}$ | C. | b=$\frac{n}{11.2}$ | D. | b=11.2n |
5.某恒温密闭容器中,可逆反应A(s)?B+C(g)-Q达到平衡.缩小容器体积,重新达到平衡时,C(g)的浓度与缩小体积前的平衡浓度相等.以下分析正确的是( )

| A. | 产物B的状态只能为固态或液态 | |
| B. | 平衡时,单位时间内n(A)消耗:n(C)消耗=1:1 | |
| C. | 保持体积不变,向平衡体系中加入A,平衡向正反应方向移动 | |
| D. | 若开始时向容器中加入1 mol B和1 mol C,达到平衡时放出热量Q |
 合成它的单体可能有( )
合成它的单体可能有( ) ) ②丙烯醇(CH2═CH-CH2OH)
) ②丙烯醇(CH2═CH-CH2OH)