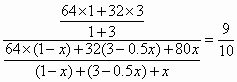题目内容
将1体积二氧化硫与3体积氧气的混合气,在450℃时通过![]() 催化剂,发生如下反应:
催化剂,发生如下反应:
![]()
![]()
![]()
若在同温同压下测得反应前后与反应后混合气的密度之比为9:10,计算二氧化硫的转化率.
答案:80%
解析:
解析:
|
要计算二氧化硫的转化率,关键是求出二氧化硫转化为三氧化硫的体积.要求出二氧化硫的转化体积,就要写出平衡的化学方程式,找出起始混合气与平衡混合气的体积关系.设二氧化硫转化体积为
起始 1V 3V O 转化 平衡 求出反应前混合密度和反应后混合气的密度.按照题意,当反应前后混合气密度之比为9:10时,即可求出二氧化硫转化的 解答:方法(1) 设:生成
起始(V) 1 3 O 平衡(V) 起始混合气与平衡混合气的密度之比(均按标准状况下计算)为
二氧化硫的转化率为:
方法(2)根据同温同压下反应前后混合气的密度之比等于混合气气体体积的反比,可列出以下等式
二氧化硫的转化率为80% 方法(3) 设:
2V 1V 2V
二氧化硫的转化率为80% |

练习册系列答案
相关题目