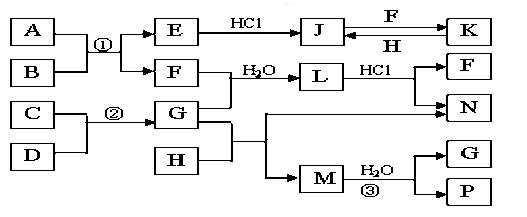
题目内容
常温下,有关水溶液pH的下列说法中正确的是( )
分析:A.碱性溶液中,水电离出的氢氧根离子浓度等于溶液中氢离子浓度;
B.弱电解质溶液中,酸浓度大于氢离子浓度,碱浓度大于氢氧根离子浓度;
C.若强酸强碱溶液混合后呈中性,则氢离子和氢氧根离子的物质的量相等;
D.含有等物质的量的HNO3、Na2CO3、CH3COOH的溶液混合后,溶液中的溶质是醋酸钠、硝酸钠,强碱弱酸盐溶液呈碱性.
B.弱电解质溶液中,酸浓度大于氢离子浓度,碱浓度大于氢氧根离子浓度;
C.若强酸强碱溶液混合后呈中性,则氢离子和氢氧根离子的物质的量相等;
D.含有等物质的量的HNO3、Na2CO3、CH3COOH的溶液混合后,溶液中的溶质是醋酸钠、硝酸钠,强碱弱酸盐溶液呈碱性.
解答:解:A.pH=12的碱溶液中,c(H+)=10-12mol?L-1,碱性溶液中,水电离出的氢氧根离子浓度等于溶液中氢离子浓度,所以水电离出的c(OH-)=10-12mol?L-1,故A错误;
B.如果酸是弱酸,则混合溶液呈酸性,如果碱是弱碱,则混合溶液呈碱性,故B错误;
C.若强酸强碱溶液等体积混合后呈中性,则pH酸+pH碱=14,酸和碱溶液的体积未知,所以不能确定pH酸+pH碱=14,故C错误;
D.含有等物质的量的HNO3、Na2CO3、CH3COOH的溶液混合后,溶液中的溶质是醋酸钠、硝酸钠,醋酸钠是强碱弱酸盐,所以其溶液呈碱性,故D正确;
故选D.
B.如果酸是弱酸,则混合溶液呈酸性,如果碱是弱碱,则混合溶液呈碱性,故B错误;
C.若强酸强碱溶液等体积混合后呈中性,则pH酸+pH碱=14,酸和碱溶液的体积未知,所以不能确定pH酸+pH碱=14,故C错误;
D.含有等物质的量的HNO3、Na2CO3、CH3COOH的溶液混合后,溶液中的溶质是醋酸钠、硝酸钠,醋酸钠是强碱弱酸盐,所以其溶液呈碱性,故D正确;
故选D.
点评:本题考查了弱电解质的电离、酸碱混合溶液酸碱性的判断等知识点,易错选项是D,明确混合后溶液中的溶质即可正确判断,难度中等.

练习册系列答案
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案
相关题目


 H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大
H++Cl-+HClO,加入的CaCO3粉末与H+反应,平衡正向移动,HClO浓度增大 (2009?合肥三模)A、B、C、D、E是中学常见的单质,X是化合物.A为金属,原子最外层p轨道上只有一个电子,可与NaOH溶液反应;B是常见的金属,其基态原子的外围电子排布式为3d64s2;常温下C是气态非金属单质,可以燃烧;D是空气主要成分之一,可与C发生重要工业反应生成X;E是固体非金属单质,在氧气中燃烧时有明亮的蓝紫色火焰.根据上述物质的信息,回答下列有关问题:
(2009?合肥三模)A、B、C、D、E是中学常见的单质,X是化合物.A为金属,原子最外层p轨道上只有一个电子,可与NaOH溶液反应;B是常见的金属,其基态原子的外围电子排布式为3d64s2;常温下C是气态非金属单质,可以燃烧;D是空气主要成分之一,可与C发生重要工业反应生成X;E是固体非金属单质,在氧气中燃烧时有明亮的蓝紫色火焰.根据上述物质的信息,回答下列有关问题: