题目内容
3.某温度下,在甲、乙、丙、三个恒容密闭容器中投入H2和I2,发生反应H2(g)+I2(g)?2HI(g),反应体系中各物质浓度的有关数据如下.| 容器 | 起始浓度 | 平衡浓度 | |
| c(H2)/mol•L-1 | c(I2)/mol•L-1 | c(HI)/mol•L-1 | |
| 甲 | 0.01 | 0.01 | 0.004 |
| 乙 | 0.01 | 0.02 | a |
| 丙 | 0.02 | 0.02 | b |
| A. | 平衡时,H2的转化率:甲<丙 | B. | HI的平衡浓度:a>0.004;b=0.008 | ||
| C. | 平衡时,乙中H2的转化率等于20% | D. | 丙反应的平衡常数K=4 |
分析 某温度下,反应H2(g)+I2(g)?2HI(g),反应前后气体体积不变,增大压强不改变化学平衡,
A.甲、丙比较,起始物质的量为2倍关系,且物质的量比等于化学计量数之比,增大压强平衡不移动;
B.甲、乙比较,乙中碘的浓度大,促进氢气的转化;甲、丙比较,起始物质的量为2倍关系,;
C.由甲中数据可知,甲中氢气转化率为$\frac{0.004×\frac{1}{2}}{0.01}$×100%=20%,但甲、乙比较,乙中碘的浓度大,促进氢气的转化;
D.甲、丙温度相同,K相同,结合表格中数据可知,K=$\frac{(0.004)^{2}}{(0.01-0.002)×(0.01-0.002)}$.
解答 解:A.甲、丙比较,起始物质的量为2倍关系,且物质的量比等于化学计量数之比,增大压强平衡不移动,则平衡时,H2的转化率:甲=丙,故A错误;
B.甲、乙比较,乙中碘的浓度大,促进氢气的转化;甲、丙比较,起始物质的量为2倍关系,则HI的平衡浓度:a>0.004;b=0.008,故B正确;
C.由甲中数据可知,甲中氢气转化率为$\frac{0.004×\frac{1}{2}}{0.01}$×100%=20%,但甲、乙比较,乙中碘的浓度大,促进氢气的转化,则平衡时,乙中H2的转化率大于20%,故C错误;
D.甲、丙温度相同,K相同,结合表格中数据可知,甲中K=$\frac{(0.004)^{2}}{(0.01-0.002)×(0.01-0.002)}$=0.25,则丙中反应的平衡常数K=0.25,故D错误;
故选B.
点评 本题考查化学平衡的计算,为高频考点,把握表格中数据、转化率及K的计算、等效平衡的判断为解答的关键,侧重分析与计算能力的考查,注意选项A为解答的难点,题目难度不大.

| A. |  除去粗盐水中的泥沙 | B. |  灼烧海带 | ||
| C. |  检验蔗糖是否水解 | D. | 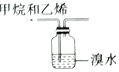 除去甲烷中的乙烯 |
| A. | Cr | B. | ds 区元素 | C. | ⅡA族元素 | D. | ⅦB族元素 |
| A. | 硅胶常用于作干燥剂 | |
| B. | 氢氟酸可以用来刻蚀玻璃 | |
| C. | 硅的化学性质很稳定,主要以游离态存在于自然界 | |
| D. | 硅酸钠的水溶液俗称水玻璃,可用于制备木材防火剂 |
| A. | 向一定量的AgNO3溶液中加入氨水至沉淀消失 | |
| B. | 向FeCl3溶液中加入KSCN溶液 | |
| C. | 向一定量的CuSO4溶液中加入氨水至沉淀消失 | |
| D. | 向硫酸铝溶液中加入氨水 |
| A. | 氧 | B. | 硫 | C. | 铍 | D. | 氮 |
| A. | Cl2是一种黄绿色的有毒气体 | B. | 红热的铁丝在Cl2中燃烧生成FeCl2 | ||
| C. | 工业上用Cl2和石灰乳制造溧白粉 | D. | 新制氯水应避光保存 |
| A. | 原子相对原子质量增加 | B. | 元素化合价呈周期性变化 | ||
| C. | 核电荷数逐渐增加 | D. | 核外电子排布呈周期性变化 |