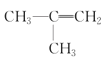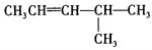题目内容
【题目】电导率是衡量电解质溶液导电能力大小的物理量。常温下,将相同体积的盐酸和氨水分别加水稀释,溶液的电导率随加入水的体积V(H2O)变化的曲线如图所示,下列说法正确的是

A. 曲线I表示盐酸加水稀释过程中溶液电导率的变化
B. a、b、c三点溶液的pH:a>b>c
C. 将a、b两点溶液混合,所得溶液中:c(Cl-)=c(NH4+)+c(NH3·H2O)
D. 氨水稀释过程中,c(NH4+)/ c(NH3·H2O)不断减小
【答案】B
【解析】
A.加水稀释时,一水合氨进一步电离,导电能力变化较小,则曲线I为氨水稀释曲线,故A错误;
B.盐酸显酸性,氨水显碱性,导电能力越大,说明离子浓度越大,则a、b、c三点溶液的pH:a>b>c,故B正确;
C. 将a、b两点溶液混合,由于氨水浓度大于盐酸浓度,反应后氨水过量,所以溶液显碱性,c(Cl-)<c(NH4+)+c(NH3·H2O),故C错误;
D. 氨水稀释过程中,Kb= c(NH4+)·c(OH-)/c(NH3·H2O)不变,而c(OH-)减小,所以c(NH4+)/c(NH3·H2O)不断增大,故D错误;
故选B。

练习册系列答案
相关题目