题目内容
19.下列说法正确的是( )| A. | 1mol氯化钠中含有NA个氯化钠分子 | |
| B. | 标准状况下,6g金刚石中含有2NA个碳碳单键 | |
| C. | 在SiO2晶体中,1molSiO2含有2NA个硅氧键 | |
| D. | 在12g石墨片层结构中,含有六元环的个数为0.5NA |
分析 A、氯化钠是由离子构成的;
B、求出金刚石的物质的量,然后根据1mol金刚石中含2mol碳碳键来分析;
C、1mol二氧化硅中含4mol硅氧键;
D、求一个六元碳环中含有1×$\frac{1}{3}$×6=2个C结合石墨的物质的量计算.
解答 解:A、氯化钠是由离子构成的,不含氯化钠分子,故A错误;
B、6g金刚石的物质的量为0.5mol,而1mol金刚石中含2mol碳碳键,故0.5mol金刚石中共含NA条碳碳键,故B错误;
C、1mol二氧化硅中含4mol硅氧键,即含4NA条,故C错误;
D、12g单层石墨的物质的量为1mol,一个六元碳环中含有1×$\frac{1}{3}$×6=2个C,所以12g单层石墨中含有六元环的个数为0.5NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
9.向某密闭容器中加入0.3mol A、0.1mol C和一定量的B三种气体,在一定条件下发生反应,各物质浓度随时间的变化如甲图所示[t0~t1阶段c(B)未画出].图乙为t2时刻后改变条件平衡体系中化学反应速率随时间变化的情况,四个阶段各改变一种条件并且改变的条件均不同.已知,t3~t4阶段为使用催化剂.下列说法正确的是( )
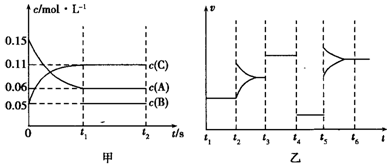

| A. | 若t1=15s,生成物C在t0~t1时间段的化学反应速率为0.004mol•L-1•s-1 | |
| B. | t4~t5阶段改变的条件为降低反应温度 | |
| C. | B的起始物质的量为0.02mol | |
| D. | t5~t6阶段可能是增大压强 |
7.在密闭容器中发生反应:mA(g)+nB(g)?pC(g)+qD(g) 反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,B的浓度为原平衡状态的2.2倍.下列叙述不正确的是( )
| A. | 平衡向逆反应方向移 动 | B. | (m+n)<(p+q) | ||
| C. | D的物质的量浓度小于原平衡 | D. | B的转化率变小 |
14.关于反应2Na2O2+2CO2═2Na2CO3+O2 的下列说法正确的是( )
| A. | CO2是还原剂,在该反应中被氧化 | |
| B. | Na2O2是氧化剂,在该反应中发生氧化反应 | |
| C. | 氧化剂和还原剂的物质的量之比为1:2 | |
| D. | 若有2 mol Na2O2参加反应,则有2 mol电子转移 |
4.下列除去杂质的方法不正确的是( )
| A. | 镁粉中有少量铝粉:加入过量烧碱溶液充分反应,过滤、洗涤、干燥 | |
| B. | 用过量氨水除去Fe3+溶液中的少量Al3+ | |
| C. | 用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水 | |
| D. | Al(OH)3中混有少量Mg(OH)2:加入足量烧碱溶液,充分反应,过滤,向滤液中通入过量二氧化碳过滤、洗涤、干燥 |
11.某溶液中含有下列离子Na+、Fe3+、Cl-、Fe2+、Al3+ 向其中先加入足量的Na2O2,然后微热并搅拌,再加入足量的稀盐酸原溶液中离子物质的量基本不变的为( )
| A. | Al3+ | B. | Fe3+ | C. | Cl- | D. | Fe2+ | ||||
| E. | Na+ |
8.把铁片放入下列溶液中,铁片溶解,溶液质量增加,反应又没有气体放出的是( )
| A. | 硝酸钠溶液 | B. | 硫酸铜溶液 | C. | 稀硫酸 | D. | 氯化铁溶液 |
9.2016年诺贝尔化学奖授予美国、法国、荷兰的三位科学家,以表彰他们在分子机器设计与合成领域的杰出贡献.下列物质是由分子构成的是( )
| A. | 金刚石 | B. | 氧化铝 | C. | 聚乙烯 | D. | 不锈钢 |
 .
.