题目内容
【题目】下列为某学生在实验室中制备高锰酸钾晶体的流程图。
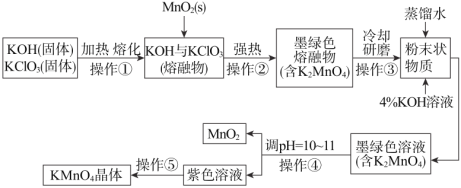
根据上图回答下列问题:
(1)操作①和②均需在坩埚中进行,根据实验实际应选择坩埚为_____(填字母);
a.石英坩埚 b.氧化铝坩埚 c.铁坩埚
(2)已知:3MnO42-+2H2O2MnO4-+MnO2+4OH-。操作④中通CO2调pH=10~11,其目的是_____;
(3)得到墨绿色溶液后,也可用如图所示方法制备KMnO4,电极均为铂电极。
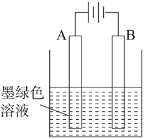
①A极上的电极反应式为_____;
②这种方法与上面的方法相比,其优点是_____;
(4)实验室中,可用0.10mol/L,草酸作标准溶液,利用下述反应,测定所得KMnO4晶体的纯度。5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O
取agKMnO4晶体样品配制成100mL溶液。每次取20.00mL于锥形瓶中进行滴定实验两次。两次实验所用草酸标准溶液的体积分别为22.15mL和22.17mL,由此求得KMnO4晶体的纯度为_______。
【答案】c 有利于平衡向右进行,提高MnO42-转化率 MnO42--e-=MnO4- 无副产品,产率高,工艺简便 ![]() 或
或![]() %
%
【解析】
在碱性条件下氯酸钾与二氧化锰加热熔融发生氧化还原反应,二氧化锰被氧化成锰酸钾,对生成物加强热形成熔融混合物,冷却研磨后溶于水得墨绿色K2MnO4溶液,K2MnO4溶液中加入氢氧化钾溶液再调节PH值为10~11,使MnO42-发生歧化反应,生成MnO4-和MnO2,趁热过滤除去二氧化锰,得高锰酸钾溶液,冷却结晶得高锰酸钾晶体,据此分析解答。
(1)操作①和②中均有强碱性物质加热,所以不能用含有与碱反应的成份的坩埚,石英(二氧化硅)和氧化铝都可与强碱反应,铁不与强碱反应,故答案选c;
(2)已知:3MnO42-+2H2O2MnO4-+MnO2+4OH-。操作④是使MnO42-发生歧化反应,生成MnO4-和MnO2,通CO2可消耗氢氧根,使平衡正向移动,有利于提高MnO42-转化率;
(3)①电解K2MnO4溶液(绿色)的方法制造KMnO4,根据图示,电解过程中A极为阳极,是K2MnO4发生氧化反应生成KMnO4,电极反应式为MnO42--e-=MnO4-;
②这种方法与上面的方法相比,其优点是无副产品,产率高,工艺简便;
(4)两次实验中滴定20mL样品试液消耗草酸标准溶液的体积分别为22.15mL和22.17mL,则滴定过程消耗草酸标准溶液的平均体积为![]() =22.16mL,根据反应5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O,每20mL样品试液中n(KMnO4)=
=22.16mL,根据反应5H2C2O4+2KMnO4+3H2SO4=10CO2↑+2MnSO4+K2SO4+8H2O,每20mL样品试液中n(KMnO4)=![]() n(H2C2O4)=
n(H2C2O4)= ![]() ×22.16×10-3L×0.1 mol/L=8.846×10-4mol,则100mL样品试液中n(KMnO4)=
×22.16×10-3L×0.1 mol/L=8.846×10-4mol,则100mL样品试液中n(KMnO4)=![]() ×8.846×10-4mol=4.432×10-3mol,则KMnO4晶体的纯度为
×8.846×10-4mol=4.432×10-3mol,则KMnO4晶体的纯度为![]() =
=![]() (或
(或![]() %)。
%)。