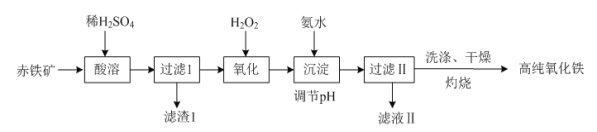
题目内容
【题目】我校环保兴趣小组在处理污水样品时,需用质量分数为37%的浓盐酸(密度为1.19g/cm3)配制成250mL 0.1mol·L-1的盐酸溶液。
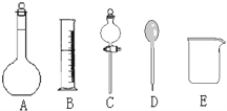
(1)在图所示仪器中,配制上述溶液不需要的是________(填序号);除图中已有仪器外,配制上述溶液还需要的玻璃仪器是________。
(2)根据计算,下列量程或规格中,本实验量筒应使用的是________;
A.10mL B.100mL C.250mL D.500mL
(3)在量取浓盐酸后,下列操作先后顺序是(用编号表示)________。
①待稀释的盐酸温度与室温一致后,沿玻璃棒注入所选定规格的容量瓶中。
②往容量瓶中小心加蒸馏水至液面接近环形刻度线1~2cm处,改用胶头滴管加蒸馏水,使凹液面最低处与瓶颈的环形刻度线相切。
③在盛盐酸的烧杯中注入适量蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
(4)在容量瓶的使用方法中,下列操作正确的是________。
A.使用容量瓶前不用检查它是否漏水
B.容量瓶用水洗净后,再用配好的稀HCl溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加水至接近刻度线处,1~2cm用胶头滴管加蒸馏水至刻度线
D.配制溶液时,若试样是液体,用量筒取试样后直接倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀
(5)若定容后摇匀静置,发现凹液面低于刻度线,此时应该________。
A.直接转移到细口试剂瓶中
B.再用胶头滴管加水,重新定容
C.将此溶液倒掉,重新配制
D.直接贮存于容量瓶中
【答案】C 玻璃棒 A ③①④② E A
【解析】
(1)根据配制一定物质的量浓度的溶液使用的仪器回答;
(2)根据![]() 计算出需要浓盐酸的浓度,再根据配制250mL 0.1molL-1的盐酸溶液需要的氯化氢的物质的量计算出需要的体积;
计算出需要浓盐酸的浓度,再根据配制250mL 0.1molL-1的盐酸溶液需要的氯化氢的物质的量计算出需要的体积;
(3)根据操作步骤选择顺序;
(4)根据容量瓶的正确使用方法进行判断;
(5)若定容后摇匀静置,发现凹液面低于刻度线,此时应该直接转移到细口试剂瓶中;
(1)分液漏斗用来萃取和分液,配制一定物质的量浓度溶液不用分液漏斗,答案为C;在浓盐酸稀释时用玻璃棒搅拌,转移液体时用玻璃棒引流,故答案为:玻璃棒;
(2) 密度为1.19g/cm3质量分数为37%的浓盐酸的物质的量浓度为:![]() =11.9 mol·L-1,配制成250mL 0.1mol·L-1,需浓盐酸体积
=11.9 mol·L-1,配制成250mL 0.1mol·L-1,需浓盐酸体积![]() ,故选择10mL量筒,答案选A;
,故选择10mL量筒,答案选A;
(3)量取浓盐酸后,要进行稀释、冷却、转移、洗涤、定容等步骤;答案为:③①④②;
(4)A.容量瓶使用时,应先检查是否漏水,然后用蒸馏水洗涤干净即可, A错误;
B. 容量瓶洗净后不能用所配制溶液润洗,否则影响配制的溶液的浓度,B错误;
C. 容量瓶只能用来配制溶液,不能在容量瓶中溶解,应该在烧杯中溶解,C错误;
D. 容量瓶只能用来配制溶液,若试样是液体,用量筒取试样后应该在烧杯中稀释,D错误;
E. 摇匀时,盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转,E正确;
答案为E;
(5)由于摇匀后,在容量瓶的刻度线上方有部分溶液,所以溶液液面会低于刻度线,不需要专门处理,可以将配制的溶液直接转移到细口试剂瓶中,答案选A。

【题目】在一固定容积的密闭容器中进行着如下反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其平衡常数K和温度t的关系:
CO(g)+H2O(g),其平衡常数K和温度t的关系:
t℃ | 700 | 800 | 850 | 1000 | 1200 |
K | 2.6 | 1.7 | 1.0 | 0.9 | 0.6 |
(1)K的表达式为:_________;
(2)该反应的正反应为_________反应(“吸热”或“放热”);
(3)下列选项中可作为该反应在850℃时已经达到化学平衡状态的标志的是:_________。
A.容器中压强不再变化 B.混合气体中CO浓度不再变化
C.混合气体的密度不再变化 D.c(CO2)=c(CO)=c(H2)=c(H2O)
(4)当温度为850℃,某时刻测得该温度下的密闭容器中各物质的物质的量见表:
CO | H2O | CO2 | H2 |
0.5mol | 8.5mol | 2.0mol | 2.0mol |
此时上述的反应中正、逆反应速率的关系式是_________(填代号)。
A.v(正)>v(逆) B.v(正)<v(逆) C.v(正)=v(逆) D.无法判断
(5)在700℃通过压缩体积增大气体压强,则该反应中H2(g)的转化率_________(“增大”、“减小”或“不变”);工业生产中,通过此方法使容器内气体压强增大以加快反应,却意外发现H2(g)的转化率也显著提高,请你从平衡原理解释其可能原因是__________________________________________。
Ⅱ.设在容积可变的密闭容器中充入10molN2(g)和10molH2(g),反应在一定条件下达到平衡时,NH3的体积分数为0.25。
(6)求该条件下反应N2(g)+3H2(g)![]() 2NH3(g)的平衡常数__________。(设该条件下,每1mol气体所占的体积为VL)上述反应的平衡时,再充入10mol的N2,根据计算,平衡应向什么方向移动?[需按格式写计算过程,否则答案对也不给分]__________。
2NH3(g)的平衡常数__________。(设该条件下,每1mol气体所占的体积为VL)上述反应的平衡时,再充入10mol的N2,根据计算,平衡应向什么方向移动?[需按格式写计算过程,否则答案对也不给分]__________。
【题目】某无色混合溶液中可能含有的离子如下表所示:
可能大量含有的阳离子 | H+、Al3+、NH4+、Na+ |
可能大量含有的阴离子 | Cl-、AlO2-、SO42-、MnO4-、Br-、I-、CO32- |
为探究其成分,进行了以下探究实验。
探究一:
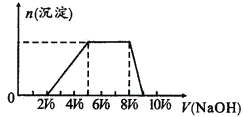
甲同学取一定量的混合溶液,用pH试纸检验,溶液pH<7;向其中逐液加入氢氧化钠溶液,产生沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)的关系如图所示。
探究二
乙同学取一定量的混合溶液,向溶液中加氯水,无气体产生,再加入CCl4振荡、静置,CCl4层呈橙红色,用分液漏斗分液;向分液后的水溶液中加入AgNO3和HNO3混合液,有白色沉淀产生。
探究三:
另取原溶液少量加入Ba(NO3)2和盐酸的混合液,产生白色沉淀。
(1)该溶液中一定含有的阴离子是___;其中能确定离子浓度之比的,对应离子物质的量浓度之比为___;不能肯定是否含有的离子是___。确定其中阳离子的实验方法为___。
(2)请写出沉淀减少过程中发生反应的离子方程式___。