题目内容
【题目】X、Y、Z三种气体,取X和Y按1∶1的物质的量之比混合,放入密闭容器中发生如下反应:X(g)+2Y(g)![]() 2Z(g),达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于( )
2Z(g),达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于( )
A.33% B.40% C.50% D.65%
【答案】D
【解析】
试题分析:假设X和Y物质的量为1mol,达平衡时消耗Y物质的量为nmol,则:
X(g)+2Y(g)![]() 2Z(g)
2Z(g)
起始量(mol): 1 1 0
变化量(mol):0.5n n n
平衡量(mol):1-0.5n 1-n n
平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则(1-0.5n+1-n):n=3:2,解得n=![]() ,Y的转化率=
,Y的转化率=![]() ×100%=67%,故选D。
×100%=67%,故选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某化学研究性学习小组用CO还原Fe2O3,并在实验结束后用磁铁吸出生成的黑色粉末X进行探究。
[探究目的] 分析黑色粉末X的组成,并进行相关实验。
[查阅资料]
I.CO还原Fe2O3的实验中若温度不同、受热不均时会生成Fe3O4,也能被磁铁吸引。
II.Fe3O4 + 8H+ = 2Fe3+ + Fe2+ + 4H2O
[猜想假设] 黑色粉末X的组成可能是_________、_________,或二者的混合物。
[实验探究]
编号 | 实验操作 | 实验现象 |
① | 取少量黑色粉末X放入试管中,注入足量的一定浓度的盐酸,微热 | 黑色粉末逐渐溶解,同时有气泡产生,溶液呈浅绿色。 |
② | 向上述试管中滴加几滴KSCN溶液,振荡 | 溶液没有呈现红色 |
(1)实验①中产生气泡的离子方程式为_________。
(2)根据②中溶液未呈红色,不能推断出黑色粉末X中无Fe3O4,请用离子方程式解释原因:_________。
(3)为了证明黑色粉末X中是否含有Fe3O4,该小组进行如下图所示实验:
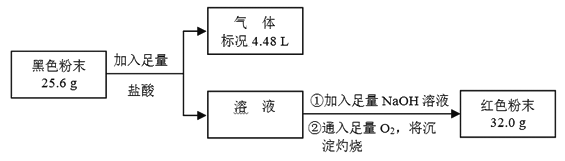
请根据数据分析说明黑色粉末X中是否含有Fe3O4。
_________。

