题目内容
12.在某温度下,A+B?2C反应达到化学平衡.(1)升高温度时,C的物质的量浓度减小,则正反应是放热反应,V正加快V逆加快(减慢或加快),平衡向逆反应方向移动.
(2)若B为气态,增大压强平衡不发生移动,则A是气态,C是气态.
(3)若增减B的量,平衡不发生移动,则B是液态或固态.
分析 (1)温度升高,平衡向正反应方向移动,升高温度向吸热的方向移动;
(2)B为固体,降低压强时,平衡向逆反应方向移动,减小压强向体积增大的方向移动,以此来解答;
(3)对于反应前后气体系数和相等的反应,压强不会引起平衡的移动.
解答 解:(1)温度升高,正逆反应速率加快,C的物质的量浓度减小,说明平衡向逆反应方向移动,V正小于V逆,升高温度向吸热的方向移动,所以正反应为放热反应,
故答案为:放;加快;加快;逆反应方向
(2)若B是气态,加压时,平衡不移动,则反应前后气体系数和相等,所以A、C都是气态,故答案为:气;气;
(3)若增减B的量,平衡不发生移动,说明B一定不是气体,B是液态或固态,故答案为:液态或固.
点评 本题考查化学平衡的影响因素,熟悉温度、压强对平衡的影响即可解答,注意物质的状态及化学计量数的关系,题目难度不大.

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目
19.下列混合物能用分液法分离的是( )
| A. | 乙醇与乙酸 | B. | 苯和硝基苯 | ||
| C. | 乙酸乙酯和Na2CO3溶液 | D. | 乙醛与水 |
3.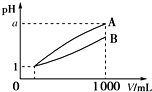 pH=1的两种酸溶液A、B各1mL,分别加水稀释到1 000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
pH=1的两种酸溶液A、B各1mL,分别加水稀释到1 000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
 pH=1的两种酸溶液A、B各1mL,分别加水稀释到1 000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )
pH=1的两种酸溶液A、B各1mL,分别加水稀释到1 000mL,其pH与溶液体积(V)的关系如图所示,下列说法不正确的是( )| A. | 若a=4,则A是强酸,B是弱酸 | |
| B. | 稀释后,A酸溶液的酸性比B酸溶液强 | |
| C. | A、B两种酸溶液的物质的量浓度一定不相等 | |
| D. | 若1<a<4,则A、B都是弱酸 |
7.对平衡CO2(g)?CO2(aq);△H<0,为增大二氧化碳气体在水中的溶解度,应采用的方法是( )
| A. | 升温增压 | B. | 降温减压 | C. | 升温减压 | D. | 降温增压 |
17.下列物质互为同位素的一组是( )
| A. | 12C和14C | B. | NO和NO2 | C. | 12CO和14CO | D. | 14N和14C |
4.镁条在空气中燃烧后,其生成物中可能含有的物质是( )
| A. | MgCO3、MgO、Mg3N2 | B. | Mg(OH)2、MgO、MgCO3 | C. | MgO、Mg3N2、C | D. | Mg3N2、C、MgCO3 |
1.AgCl 和Ag2CrO4 的溶度积分别为1.8×10-10mol2•L-2和2.0×10-12mol3•L-3,若用难溶盐在溶液中的浓度来表示其溶解度,则下面的叙述中正确的是( )
| A. | AgCl 和Ag2CrO4 的溶解度相等 | |
| B. | 由Ksp的相对大小可以直接判断出AgCl的溶解度大于 Ag2CrO4 | |
| C. | 两者类型不同,不能由Ksp的大小直接判断溶解能力的大小 | |
| D. | 都是难溶盐,溶解度无意义 |
 在100mLNaOH溶液中加入NH4NO3 和(NH4)2SO4 的固体混合物,加热使之充分反应,如图表示加入固体的质量与产生气体的体积(标准状况)的关系.试计算:
在100mLNaOH溶液中加入NH4NO3 和(NH4)2SO4 的固体混合物,加热使之充分反应,如图表示加入固体的质量与产生气体的体积(标准状况)的关系.试计算: