题目内容
【题目】把1.0mol/L CuSO4溶液、1.0mol/L Fe2(SO4)3溶液两种溶液等体积混合(假设混合后液体的体积等于混合前两种溶液的体积之和),向溶液中加入足量铁粉,经足够长的时间后,铁粉有剩余.此时溶液中Fe2+的物质的量浓度为
A. 1.0 mol/L B. 2.0 mol/L C. 3.0 mol/L D. 4.0 mol/L
【答案】B
【解析】试题分析:把1.0mol/LCuSO4和1.0mol/L Fe2(SO4)3溶液等体积混合,稀释前后溶质的物质的量不变,则混合后溶液中c(CuSO4)=![]() ×1.0mol/L=0.5mol/L,c(H2SO4)=
×1.0mol/L=0.5mol/L,c(H2SO4)=![]() ×1.0mol/L=0.5mol/L,
×1.0mol/L=0.5mol/L,
混合后溶液中硫酸根来源于硫酸铜与硫酸铁电离,故 c(SO42-)=c(CuSO4)+3c[Fe2(SO4)3]=0.5mol/L+3×0.5mol/L=2mol/L,向溶液中加入铁粉,经过足够长的时间,铁粉有剩余,则硫酸铜、硫酸都完全反应,此时溶液中溶质为FeSO4,故c(Fe2+)=c(SO42-)=2mol/L,故选B。

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案【题目】二草酸合铜(Ⅱ)酸钾{K2[Cu(C2O4)2]2H2O}制备流程如图1: 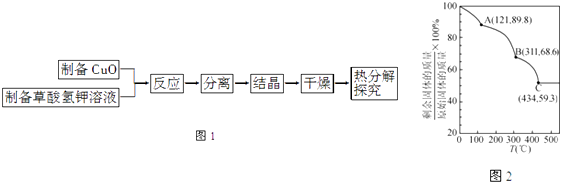
(已知H2C2O4 ![]() CO↑+CO2↑+H2O)
CO↑+CO2↑+H2O)
(1)制备CuO:CuSO4溶液中滴入NaOH溶液,加热煮沸、冷却、双层滤纸过滤、洗涤.①用双层滤纸的可能原因是 .
②用蒸馏水洗涤氧化铜时,如何证明已洗涤干净:
(2)本实验用K2CO3粉末与草酸溶液制取KHC2O4溶液而不用KOH粉末代替K2CO3粉末的可能原因是 .
(3)为了提高CuO的利用率,如何让CuO充分转移到热的KHC2O4溶液中:;50℃水浴加热至反应充分,发生反应的化学方程式为;再经趁热过滤、沸水洗涤、将滤液蒸发浓缩得二草酸合铜(Ⅱ)酸钾晶体.
(4)若实验室只有含少量FeSO47H2O的硫酸铜晶体,欲制备较纯净的CuSO4溶液.
Ⅰ.相关数据(开始沉淀的pH按金属离子浓度为1.0molL﹣1计算):
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Cu2+ | 4.7 | 6.7 |
Fe2+ | 5.8 | 8.8 |
Ⅱ.提供的试剂有:a.蒸馏水 .稀硫酸 .H2O2溶液 d.纯净的Cu(OH)2粉末 .氨水
需经过的步骤有:①、②、③、④过滤得CuSO4溶液.
(5)将制得的K2[Cu(C2O4)2]2H2O进行热重分析,结果如图2,由图2知在C点剩余固体为K2CO3和 .