题目内容
如图是一套制取并验证氯气部分化学性质的实验装置.

回答下列问题:反应的方程式:MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑
(1)装置A中,仪器a的名称叫
(2)当Cl2气流通过一段时间后,装置B中溶液的pH值
(3)当有少量Cl2气流通过后,观察到装置C中的溶液变为_
(4)当Cl2气流持续通过时,装置D中干燥的有色布条能否褪色?为什么?
(5)装置E的作用是

回答下列问题:反应的方程式:MnO2+4HCl(浓)
| ||
(1)装置A中,仪器a的名称叫
分液漏斗
分液漏斗
,该仪器中盛有的试剂为浓盐酸
浓盐酸
.(2)当Cl2气流通过一段时间后,装置B中溶液的pH值
<
<
7(填“>”“<”或“=”),写出Cl2与水反应的方程式Cl2+H2O═HCl+HClO
Cl2+H2O═HCl+HClO
(3)当有少量Cl2气流通过后,观察到装置C中的溶液变为_
蓝色
蓝色
色,反应的离子方程式为Cl2+2I -=2Cl-+I2
Cl2+2I -=2Cl-+I2
.(4)当Cl2气流持续通过时,装置D中干燥的有色布条能否褪色?为什么?
不能,因为干燥的氯气没有漂白性
不能,因为干燥的氯气没有漂白性
.(5)装置E的作用是
吸收多余的氯气
吸收多余的氯气
.分析:(1)分析装置图和仪器,装置A是氯气的发生装置,利用分液漏斗将浓盐酸滴入烧瓶中加热反应;
(2)氯气既溶解于水又和水反应生成盐酸和次氯酸溶液呈酸性;
(3)装置C中通过氯气会发生氧化还原反应,氯气氧化碘离子为碘单质遇到淀粉变蓝;
(4)氯气遇到干燥的有色布条不能褪色,起漂白作用的是次氯酸;
(5)氯气是污染性气体,不能排放到空气中,需要用氢氧化钠溶液吸收.
(2)氯气既溶解于水又和水反应生成盐酸和次氯酸溶液呈酸性;
(3)装置C中通过氯气会发生氧化还原反应,氯气氧化碘离子为碘单质遇到淀粉变蓝;
(4)氯气遇到干燥的有色布条不能褪色,起漂白作用的是次氯酸;
(5)氯气是污染性气体,不能排放到空气中,需要用氢氧化钠溶液吸收.
解答:解:(1)分析装置图和仪器,装置A是氯气的发生装置,利用分液漏斗将浓盐酸滴入烧瓶中加热反应;
故答案为:分液漏斗,浓盐酸;
(2)氯气既溶解于水又和水反应生成盐酸和次氯酸,反应化学方程式为:Cl2+H2O═HCl+HClO,溶液呈酸性,溶液PH小于7;
故答案为:<,Cl2+H2O═HCl+HClO;
(3)装置C中通过氯气会发生氧化还原反应,氯气氧化碘离子为碘单质,反应离子方程式为:Cl2+2I -=2Cl-+I2,碘单质遇到淀粉变蓝;
故答案为:蓝色;Cl2+2I -=2Cl-+I2;
(4)氯气遇到干燥的有色布条不能褪色,起漂白作用的是次氯酸,因为干燥氯气不能使干燥的有色布条褪色无漂白性;
故答案为:不能,因为干燥的氯气没有漂白性;
(5)氯气是污染性气体,不能排放到空气中,需要用氢氧化钠溶液吸收;
故答案为:吸收多余的氯气.
故答案为:分液漏斗,浓盐酸;
(2)氯气既溶解于水又和水反应生成盐酸和次氯酸,反应化学方程式为:Cl2+H2O═HCl+HClO,溶液呈酸性,溶液PH小于7;
故答案为:<,Cl2+H2O═HCl+HClO;
(3)装置C中通过氯气会发生氧化还原反应,氯气氧化碘离子为碘单质,反应离子方程式为:Cl2+2I -=2Cl-+I2,碘单质遇到淀粉变蓝;
故答案为:蓝色;Cl2+2I -=2Cl-+I2;
(4)氯气遇到干燥的有色布条不能褪色,起漂白作用的是次氯酸,因为干燥氯气不能使干燥的有色布条褪色无漂白性;
故答案为:不能,因为干燥的氯气没有漂白性;
(5)氯气是污染性气体,不能排放到空气中,需要用氢氧化钠溶液吸收;
故答案为:吸收多余的氯气.
点评:本题考查了实验室制备氯气的实验装置分析判断,性质实验验证,反应现象和性质掌握是解题关键,题目难度中等.

练习册系列答案
相关题目

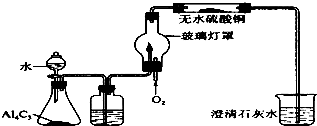 已知Al4C3+12H2O═4Al(OH)3+3CH4↑某学习小组在实验室利用如图所示装置制取甲烷,并验证甲烷的组成.
已知Al4C3+12H2O═4Al(OH)3+3CH4↑某学习小组在实验室利用如图所示装置制取甲烷,并验证甲烷的组成. 

