题目内容
18.用NA表示阿伏伽德罗常数,下列有关说法正确的是( )| A. | lmol OH一中含有9 NA个电子 | |
| B. | 46g NO2和N2O4混合物中所含原子数目为3NA | |
| C. | 常温常压下50g 46%的乙醇溶液中,所含氧原子数目为0.5NA | |
| D. | .常温下,56g铁粉与足量浓硝酸反应,电子转移数目小于3NA |
分析 A.氢氧根离子中含有10个电子,1mol氢氧根离子含有10mol电子;
B.NO2和N2O4的最简式为NO2,根据最简式计算出混合物中含有的原子数;
C.50g46%的乙醇溶液中,除乙醇含有氧原子,溶剂是水也含有氧原子;
D.铁粉不会钝化,56g铁粉的物质的量为1mol,1mol铁与足量浓硝酸反应失去3mol电子.
解答 解:A.1mol氢氧根离子含有10mol电子,应该含有10NA个电子,故A错误;
B.46gNO2和N2O4混合物中相当于含有46g二氧化氮,46gNO2的物质的量为$\frac{46g}{46g/mol}$=1mol,含有3mol原子,所含原子数目为3NA,故B正确;
C.50g 46%的乙醇溶液中含有乙醇的质量为:50g×46%=23g,物质的量为$\frac{23g}{46g/mol}$=0.5mol,0.5mol乙醇分子中含有0.5molO,由于水分子中也含有氧原子,所以该溶液中含有的氧原子大于0.5mol,所含氧原子数目大于0.5NA,故C错误;
D.56g铁粉与足量浓硝酸反应,铁粉是粉末状,不会钝化,能完全反应,所以电子转移数目为3NA,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.

练习册系列答案
相关题目
8.短周期元素在周期表中的位置关系如图所示.
(1)X元素的单质的分子式是He,若X核内中子数与质子数相等,则X的摩尔质量为4g/mol.
(2)Y与氢化合形成的化合物的结构式为H-F,在同主族元素的氢化物分子中,该氢化物分子中共价键键能最大,原因是同主族中F原子半径最小,故H-F键长最短,H-F键最稳定,H-F键能最大.
(3)Z单质的晶体属于分子晶体,Z的氢化物的电子式是 ,该分子中含2个σ键,0个π键(若不含填0).
,该分子中含2个σ键,0个π键(若不含填0).
| X | ||
| Y | ||
| Z |
(2)Y与氢化合形成的化合物的结构式为H-F,在同主族元素的氢化物分子中,该氢化物分子中共价键键能最大,原因是同主族中F原子半径最小,故H-F键长最短,H-F键最稳定,H-F键能最大.
(3)Z单质的晶体属于分子晶体,Z的氢化物的电子式是
 ,该分子中含2个σ键,0个π键(若不含填0).
,该分子中含2个σ键,0个π键(若不含填0).
9.“生活垃圾分类”活动,对提升城市文明和生活质量具有积极的意义.下列四个图为城市生活垃圾分类的标志,则废弃旧电池属于( )
| A. |  可回收垃圾 | B. |  餐厨垃圾 | C. |  有害垃圾 | D. |  其他垃圾 |
6.下列变化中,可由两种单质直接化合生成的是( )
| A. | Fe→FeCl2 | B. | Na→Na2O2 | C. | S→SO3 | D. | N2→NO2 |
13.汽车尾气中二氧化硫、氮氧化物和可吸入颗粒物是雾霾主要组成.某课题组用汽车尾气为原料探究二氧化硫、氮氧化物的化学性质.
I.汽车尾气(含有烃类、CO、SO2与NO等物质),冶理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂).它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化.写出一氧化碳与一氧化氮反应的化学方程式:2CO+2NO?2CO2+N2
Ⅱ.课题组欲在绿色环保的条件下探究大气污染物SO2的性质,设计如图实验装置.请回答:
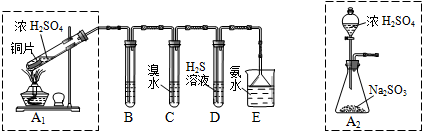
(1)B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为品红溶液;
C中反应的离子方程式为SO2+Br2+2H2O═SO42-+2Br-+4H+.
(2)为了实现绿色环保的目标,制取SO2装置最好选择A2.(A1或A2装置)用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子.请回答:
(3)氨水吸收过量SO2的反应的离子方程式为NH3•H2O+SO2=NH4++HSO3-.
(4))已知亚硫酸氢盐一般易溶于水,SO2也易溶于水.现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、2mol/LHNO3、1mol/LBaCl2溶液、l mol/LBa(OH)2溶液、品红溶液、蒸馏水.请设计实验证明“吸收液”中存在SO32-、HSO3-,完成下表的实验操作、预期现象和结论:
I.汽车尾气(含有烃类、CO、SO2与NO等物质),冶理的方法之一是在汽车的排气管上装一个“催化转换器”(用铂、钯合金作催化剂).它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化.写出一氧化碳与一氧化氮反应的化学方程式:2CO+2NO?2CO2+N2
Ⅱ.课题组欲在绿色环保的条件下探究大气污染物SO2的性质,设计如图实验装置.请回答:

(1)B、C、D分别用于检验SO2的漂白性、还原性和氧化性,则B中所盛试剂为品红溶液;
C中反应的离子方程式为SO2+Br2+2H2O═SO42-+2Br-+4H+.
(2)为了实现绿色环保的目标,制取SO2装置最好选择A2.(A1或A2装置)用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子.请回答:
(3)氨水吸收过量SO2的反应的离子方程式为NH3•H2O+SO2=NH4++HSO3-.
(4))已知亚硫酸氢盐一般易溶于水,SO2也易溶于水.现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、2mol/LHNO3、1mol/LBaCl2溶液、l mol/LBa(OH)2溶液、品红溶液、蒸馏水.请设计实验证明“吸收液”中存在SO32-、HSO3-,完成下表的实验操作、预期现象和结论:
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取l mol/L BaCl2溶液向小烧杯滴加直至过量. | 若出现白色浑浊,则溶液中存在SO32-或 SO42-. |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体滴入1滴品红,再滴入过量2 mol/L盐酸,振荡 用试管取适量滤液,向其中滴入过量l mol/LBa(OH)2溶液(或1滴品红,再滴入2-3滴2 mol/L盐酸),振荡. 步骤3: | 若品红褪色(或有气泡)则存在SO32- 若出现白色沉淀(或品红褪色或有气泡),则存在HSO3- |
3.关于镁和铝的叙述正确的是( )
| A. | 镁、铝在常温下都能被氧气氧化 | B. | 镁、铝均须密封保存 | ||
| C. | MgO和Al2O3都是碱性氧化物 | D. | 镁铝合金的硬度比镁小 |
10.根据原子结构及元素周期律的知识,下列推断正确的是( )
| A. | 同主族元素含氧酸的酸性随核电荷数的增加而减弱 | |
| B. | 核外电子排布相同的微粒化学性质也相同 | |
| C. | ${\;}_{17}^{35}$Cl与${\;}_{17}^{37}$Cl得电子能力相同 | |
| D. | F-、O2-、Mg2+、Na+半径逐渐减小 |
7.下列各组中,互为同位素的是( )
| A. | O2和O3 | B. | 3517R和3717R | C. | 2311X和2311X+ | D. | 4018R和4020X |
7.化学无处不在,下列与化学有关的说法正确的是( )
| A. | Si有良好的半导体性能,可直接用于制备光导纤维 | |
| B. | 淀粉、纤维素、蛋白质、油脂都是天然高分子化合物 | |
| C. | 用食醋可除去热水壶内壁的水垢 | |
| D. | Cu的金属活泼性比Fe弱,故水库铁闸门上接装铜块可减缓铁腐蚀 |