题目内容
4.已知1g氢气完全燃烧生成水蒸气时放出热量a kJ,且氧气中1mol O=O键完全断裂时吸收热量bkJ,水蒸气中1mol H-O键形成时放出热量c kJ,则氢气中1mol H-H键断裂时吸收热量为$\frac{(4c-b-4a)}{2}$kJ.分析 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,1molH2O含有2molH-O键,1molH2中1mol H-H键,根据化学反应放出的热量=新键生成释放的能量-旧键断裂吸收的能量,结合反应方程式进行计算.
解答 解:1gH2的物质的量n=$\frac{m}{M}$=$\frac{1g}{2g/mol}$=0.5mol,燃烧生成水蒸气放出热量为aKJ,可知2mol氢气完全燃烧生成水蒸气时放出热量4akJ,氢气完全燃烧生成水蒸气是放热反应,所以化学反应放出的热量=新键生成释放的能量-旧键断裂吸收的能量,设氢气中1molH-H键断裂时吸收热量为x,根据方程式:2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,则:4akJ=ckJ×4-(2x+bkJ),解得x=$\frac{(4c-b-4a)}{2}$,
故答案为:$\frac{(4c-b-4a)}{2}$.
点评 本题考查学生化学反应中的能量变化知识,熟记放出的热量=新键生成释放的能量-旧键断裂吸收的能量是解题的关键,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
10.下列物质中既能与盐酸反应,又能与NaOH溶液反应的是( )
①Na2CO3 ②Al(OH)3 ③NH4HCO3 ④Al2O3.
①Na2CO3 ②Al(OH)3 ③NH4HCO3 ④Al2O3.
| A. | ①②④ | B. | ②③④ | C. | ②④ | D. | 全部 |
12.下列说法中不正确的是( )
| A. | 人体运动所消耗的能量与化学反应有关 | |
| B. | 煤和石油都属于化石燃料 | |
| C. | 化学反应必然伴随发生能量变化 | |
| D. | 不需要加热就能进行的反应都是放热反应 |
19.有四种氯化物,它们的通式为XCl2,其中最可能是第 IIA族元素的氯化物是( )
| A. | 白色固体,完全溶于水,得到一种无色中性溶液,此溶液导电性差 | |
| B. | 白色固体,易溶于水,得无色中性溶液,此溶液具有良好的导电性 | |
| C. | 白色固体,极易升华,如与水接触,可慢慢分解 | |
| D. | 绿色固体,易被氧化,得到一种蓝绿色溶液,此溶液具有良好的导电性 |
9.N2的结构可以表示为 ,CO的结构可以表示为
,CO的结构可以表示为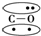 ,其中椭圆框表示π键,下列说法中不正确的是( )
,其中椭圆框表示π键,下列说法中不正确的是( )
 ,CO的结构可以表示为
,CO的结构可以表示为 ,其中椭圆框表示π键,下列说法中不正确的是( )
,其中椭圆框表示π键,下列说法中不正确的是( )| A. | N2分子与CO分子中都含有叁键 | B. | CO分子中有一个π键是配位键 | ||
| C. | N2与CO互为等电子体 | D. | N2与CO的化学性质相同 |
16.下列化学用语表达正确的是( )
| A. | HCl的电子式为 | |
| B. | S2-的结构示意图为 | |
| C. | O-16原子的符号为${\;}_{6}^{16}O$ | |
| D. | ${\;}_{12}^{6}C$、${\;}_{6}^{13}C$、${\;}_{6}^{14}C$含有相同的中子数 |
14.在无色透明酸性溶液中,能大量共存的离子组是( )
| A. | Mg2+、NO3-、Cl-、Na+ | B. | K+、SO42-、HCO3-、Na+ | ||
| C. | NH4+、NO3-、Al3+、CH3COO- | D. | MnO4-、K+、SO42-、Na+ |
