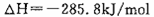题目内容
25 ℃时,合成氨反应的热化学方程式为:
N2(g)+3H2(g) 2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol
在该温度时,取2mol N2和7 mol H2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是[ ]
N2(g)+3H2(g)
 2NH3(g) △H=-92.4 kJ/mol
2NH3(g) △H=-92.4 kJ/mol在该温度时,取2mol N2和7 mol H2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是[ ]
| A.92.4 kJ | B.92.4 kJ ~184.8 kJ |
| C.小于184.8 kJ | D.184.8 kJ |
C
正确答案:C
合成氨反应是可逆反应,转化率不可能达到100%,故C正确。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 ,则H2SO4和Ba(OH)2反应的中和热为:
,则H2SO4和Ba(OH)2反应的中和热为: