题目内容
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,则
(1)在10S内Z的平均速率为 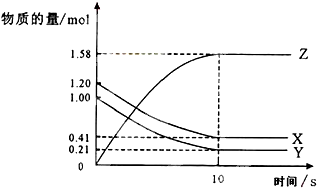
(2)该反应的化学方程式 .
(1)在10S内Z的平均速率为

(2)该反应的化学方程式
考点:反应速率的定量表示方法,化学平衡建立的过程
专题:基本概念与基本理论
分析:(1)根据v=
计算化学反应速率;
(2)根据化学反应中各物质的物质的量变化量与化学计量数之比呈正比书写化学方程式.
| △c |
| △t |
(2)根据化学反应中各物质的物质的量变化量与化学计量数之比呈正比书写化学方程式.
解答:
解:(1)反应开始到10s,用Z表示的反应速率为:v=
=
=0.079mol/(L?s),
故答案为:0.079mol/(L?s);
(2)由图象可以看出X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,
化学反应中各物质的物质的量变化量与化学计量数之比呈正比,
则有Y:X:Z=(1.20mol-0.41mol):(1.0mol-0.21mol):1.58mol=1:1:2,则反应的化学方程式为X+Y?2Z,
故答案为:X+Y?2Z;
| △c |
| △t |
| ||
| 10s |
故答案为:0.079mol/(L?s);
(2)由图象可以看出X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,
化学反应中各物质的物质的量变化量与化学计量数之比呈正比,
则有Y:X:Z=(1.20mol-0.41mol):(1.0mol-0.21mol):1.58mol=1:1:2,则反应的化学方程式为X+Y?2Z,
故答案为:X+Y?2Z;
点评:本题考查物质的量随时间的变化曲线,以及化学平衡的计算,题目难度中等,注意把握化学方程式的判断方法.

练习册系列答案
 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案
相关题目
室温条件下进行下列各组实验,其中的观察要点不能说明氨水是弱碱的是( )
| A、等浓度的氨水与盐酸溶液反应:恰好反应时的体积比 |
| B、氨水溶液中加入氯化铵固体:溶液pH的变化 |
| C、等体积等浓度的NaOH和氨水分别和铝条反应;是否反应 |
| D、将pH=13的氨水稀释成pH=12的溶液:加H2O的量 |
下列各项描述不涉及胶体知识的有( )
| A、医学上的血液透析 |
| B、清晨,在茂密的树林中,常可看到从枝叶间透过一道道光柱 |
| C、工业上生产有色玻璃 |
| D、钢铁制品在海水中比在河水中容易生锈 |
下列物质的使用不涉及化学变化的是( )
| A、明矾作净水荆 |
| B、液氨用作制冷剂 |
| C、铝制容器运输浓硫酸 |
| D、生石灰作干燥剂 |
下列各组物质中,前一种是化合物,后一种是混合物的是( )
| A、氧化钙,洁净的雨水 |
| B、氢氧化钾,含铜80%的氧化铜 |
| C、澄清的石灰水,粗盐 |
| D、红磷,空气 |
关于电解槽的叙述不正确的是( )
| A、是电能转变成化学能的装置 |
| B、与电源正极相连的是阳极 |
| C、阴极失去电子,发生氧化反应 |
| D、参与电解的阳离子移向阴极 |