��Ŀ����
(1)�����½�0.2 mol/LHCl��Һ��0.2 mol/LMOH��Һ�������ϣ���û����Һ��pH��6��������Һ����ˮ�������c(H��)__________0.2 mol/LHCl��Һ����ˮ�������c(H��)��(���������������)���û����Һ�������غ�ʽΪ ��
(2)����������0.2 mol/LMOH��Һ��0.1 mol/LHCl��Һ�������ϣ���û����Һ��pH��7����˵������ͬ������MOH�ĵ���̶�__________MCl��ˮ��̶ȡ�(���������������)
(3)����������pH��3��HR��Һ��pH��11��NaOH��Һ�������ϣ���û����Һ��pH��7��������Һ��pH__________��(���7������7������ȷ����)
(4)������Һ�ʼ��Ե�ԭ��(�����ӷ���ʽ��ʾ)__________________________��������Һ����Ũ���ɴ�С��˳��Ϊ ��
(5)ij�¶�ʱ�����0.01 mol/L��NaOH��ҺpHΪ11���ڴ��¶��£���pH��a��NaOH��ҺVa L��pH��b������Vb L��ϡ������û����ҺΪ���ԣ���a��12��b��2����Va ��Vb = ��
��ϰ��ϵ�д�
 �ǻ�С��ϰϵ�д�
�ǻ�С��ϰϵ�д�
�����Ŀ


 ����H2�ڳ����µ������
����H2�ڳ����µ������ 2N2(g) + 3H2O(g)����ע���ѵ��ʼ���������ת���ʣ�
2N2(g) + 3H2O(g)����ע���ѵ��ʼ���������ת���ʣ�
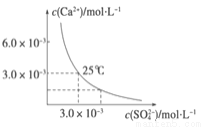
 �����й㷺����;�������к�������Fe��Zn��Cu��Pt���ʣ����õ�ⷨ�Ʊ��ߴ��ȵ���������������ȷ���ǣ���֪��������Fe2+��Ni2+��Cu2+���� ��
�����й㷺����;�������к�������Fe��Zn��Cu��Pt���ʣ����õ�ⷨ�Ʊ��ߴ��ȵ���������������ȷ���ǣ���֪��������Fe2+��Ni2+��Cu2+���� ��