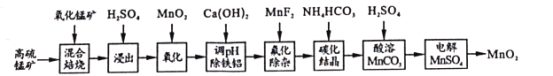
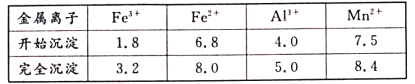
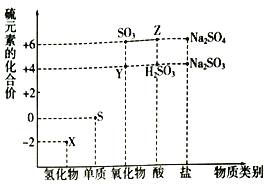
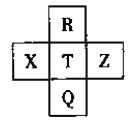
题目内容
【题目】根据所学内容回答下列问题:
(1)基态硼原子电子排布图为__________________。
(2)根据VSEPR模型判断,下列微粒中所有原子都在同一平面上的一组是_____。
A.SO![]() 和NO
和NO![]() B.NO
B.NO![]() 和SO3 C.H3O+和ClO
和SO3 C.H3O+和ClO![]() D.PO
D.PO![]() 和SO
和SO![]()
(3)第三周期某元素的前5个电子的电离能如图1所示。该元素是_____(填元素符号),判断依据是_ ______________。
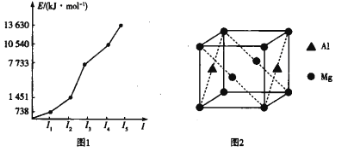
(4)铝镁合金是优质储钠材料,原子位于面心和顶点,其晶胞如图2所示。1个铝原子周围有_____________个镁原子最近且等距离。
(5) 配合物Fe(CO)5的熔点-20℃,沸点103℃,可用于制备纯铁。Fe(CO)5的结构如下图所示。下列关于Fe(CO)5说法不正确的是________。

A.Fe(CO)5是非极性分子,CO是极性分子
B.Fe(CO)5中Fe原子的配体与C22-互为等电子体
C.1mol Fe(CO)5含有5mol![]() 键
键
D.Fe(CO)5=Fe+5CO反应中没有新化学键生成
(6)独立的NH3分子中,H—N—H键键角为107°18’。如图是[Zn(NH3)6]2+的部分结构以及其中H—N—H键键角。
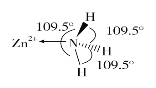
请解释[Zn(NH3)6]2+离子中H—N—H键角变为109.5°的原因是____________________________________________________________。
(7)已知立方BN晶体硬度很大,其原因是________;其晶胞结构如图所示,设晶胞中最近的B、N原子之间的距离为a nm,阿伏加德罗常数的值为NA,则晶体的密度为_____g·cm-3(列式即可,用含a、NA的代数式表示)。

【答案】![]() B Mg I3是I2的5倍多,说明最外层有2个电子 8 CD 氨分子与Zn2+形成配合物后,孤对电子与Zn2+成键,原孤对电子与成键电子对之间的排斥作用变为成键电子对之间的排斥作用,排斥作用减弱,所以H—N—H键键角变大 立方BN晶体是原子晶体,B-N键键能大,所以质地坚硬
B Mg I3是I2的5倍多,说明最外层有2个电子 8 CD 氨分子与Zn2+形成配合物后,孤对电子与Zn2+成键,原孤对电子与成键电子对之间的排斥作用变为成键电子对之间的排斥作用,排斥作用减弱,所以H—N—H键键角变大 立方BN晶体是原子晶体,B-N键键能大,所以质地坚硬 ![]()
【解析】
(1)硼原子的原子序数为5,共排布2个能层,根据能量最低原理书写电子排布式;
(2)根据价电子互斥理论判断;
(3)一般来说,元素的电离能按照第一、第二…的顺序逐渐增加,如果突然增加的比较多,电离的难度增大,这里就是元素的通常的化合价;
(4)根据晶胞图分析;
(5)根据配合物Fe(CO)5的结构图判断;
(6)孤对电子与Zn2+成键,原孤对电子与成键电子对的排斥作用减弱;
(7)原子晶体的硬度大;
(1)硼原子核外电子数为5,基态原子核外电子排布为1S12S22P1,电子排布图是![]() ;
;
(2)A.SO![]() 中S原子价层电子对个数=
中S原子价层电子对个数=![]() ,含有一个孤电子对,所以为三角锥形结构, NO
,含有一个孤电子对,所以为三角锥形结构, NO![]() 中N原子价层电子对个数=
中N原子价层电子对个数=![]() ,含有一个孤电子对,所以为V形结构,故不选A;
,含有一个孤电子对,所以为V形结构,故不选A;
B.NO![]() 中N原子价层电子对个数=
中N原子价层电子对个数=![]() ,没有孤电子对,所以为平面结构, SO3中S原子价层电子对个数=
,没有孤电子对,所以为平面结构, SO3中S原子价层电子对个数=![]() ,没有孤电子对,所以为平面结构,故选B;
,没有孤电子对,所以为平面结构,故选B;
C.H3O+中O原子价层电子对个数=![]() ,含有一个孤电子对,所以为三角锥形结构, ClO
,含有一个孤电子对,所以为三角锥形结构, ClO![]() 中Cl原子价层电子对个数=
中Cl原子价层电子对个数=![]() ,含有一个孤电子对,所以为三角锥形结构,故不选C;
,含有一个孤电子对,所以为三角锥形结构,故不选C;
D.PO![]() 中P原子价层电子对个数=
中P原子价层电子对个数=![]() ,没有孤电子对,所以为四面体结构, SO
,没有孤电子对,所以为四面体结构, SO![]() 中S原子价层电子对个数=
中S原子价层电子对个数=![]() ,含有一个孤电子对,所以为三角锥形结构,故不选D;
,含有一个孤电子对,所以为三角锥形结构,故不选D;
(3)由图示可知,I3是I2的5倍多,说明最外层有2个电子,所以该元素是Mg;
(4)根据图示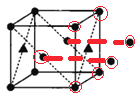 ,1个铝原子周围有8个镁原子最近且等距离;
,1个铝原子周围有8个镁原子最近且等距离;
(5)A.根据配合物Fe(CO)5的结构图,Fe(CO)5是三角双锥结构,正负电荷分布均匀,是非极性分子,CO分子中正负电荷分布不均匀,是极性分子,故A正确;
B.Fe(CO)5中Fe原子的配体是CO,价电子数是10,与C22-互为等电子体,故B正确;
C.1mol Fe(CO)5含有10mol![]() 键,故C错误;
键,故C错误;
D.Fe(CO)5=Fe+5CO是化学变化,有化学键的断裂和生成,断裂配位键、生成金属键,故D错误;
选CD;
(61)氨分子与Zn2+形成配合物后,孤对电子与Zn2+成键,原孤对电子与成键电子对之间的排斥作用变为成键电子对之间的排斥作用,排斥作用减弱,所以H—N—H键键角变大;
(7)立方BN晶体是原子晶体,B-N键键能大,所以质地坚硬;根据均摊原则,1个晶胞中含有N原子数是4、含有B原子数是![]() ,晶胞中最近的B、N原子之间的距离为a nm,则晶胞体对角线为4a nm,晶胞边长是
,晶胞中最近的B、N原子之间的距离为a nm,则晶胞体对角线为4a nm,晶胞边长是![]() nm,阿伏加德罗常数的值为NA,则晶体的密度为
nm,阿伏加德罗常数的值为NA,则晶体的密度为 =
=![]() g·cm-3。
g·cm-3。