题目内容
已知酸性高锰酸钾溶液可以将FeSO4氧化,方程
2KMnO4+10FeSO4+8H2SO4→K2SO4+2MnSO4+5Fe2(SO4)3+8H2O,
现将一定量的硫酸酸化的高锰酸钾溶液与硫酸亚铁溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中铁离子的物质的量随加入的KI的物质的量的变化关系如图所示。
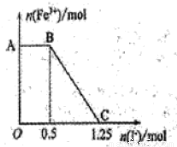
则下列有关说法错误的是
A.图中AB段主要是高锰酸钾和碘化钾溶液反应
B.图中BC段发生的反应为2Fe3++2I-= 2Fe2++ I2。
C.根据OC段的数据可知开始加入的高锰酸钾的物质的量为0.25 mol
D.根据OC段的数据可知开始加入的硫酸亚铁的物质的量为1 mol
D
【解析】
试题分析:高锰酸钾的氧化性大于铁离子,铁离子大于碘。A、AB段铁离子的物质的量不变,说明此时高锰酸钾与碘离子发生氧化还原反应,正确;B、BC段铁离子的物质的量逐渐减少至0,说明该段发生的是铁离子与碘离子的氧化还原反应,离子方程式是2Fe3++2I-= 2Fe2++ I2,正确;C、根据以上分析,高锰酸钾先氧化亚铁离子,剩余的再氧化碘离子,铁离子氧化碘离子,所以相当于高锰酸钾直接与碘离子发生氧化反应,共消耗1.25molI-。碘离子的物质的量是1.25mol,则失去电子的物质的量是1.25mol,高锰酸钾氧化碘离子为单质碘,自身被还原为+2价锰离子,根据得失电子守恒,所以用于与碘离子反应的高锰酸钾的物质的量是1.25mol/5=0.25mol,正确;D、由图像可知铁离子消耗碘离子的物质的量是1.25-0.5=0.75mol,根据2Fe3++2I-= 2Fe2++ I2,所以亚铁离子的物质的量是0.75mol,则硫酸亚铁的物质的量是0.75mol,错误,答案选D。
考点:考查物质氧化性的应用,对图像的分析与计算

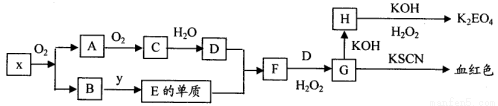


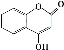 可用来制备抗凝血药,通过下列路线合成:
可用来制备抗凝血药,通过下列路线合成: