题目内容
某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMNO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
试回答:
根据上表中的实验数据,可以得到的结论是
该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图甲所示.但有同学查阅已有的资料发现,该实验过程中n(Mn2+)随时间变化的趋势如图乙所示.该小组同学根据乙图所示信息提出了新的假设,并继续进行实验探究.

该小组同学提出的假设是
请你帮助该小组同学完成实验方案,并填写下表中的空白
若该小组同学提出的假设成立,应观察到的现象为
【实验原理】2KMNO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
| 实验 编号 |
室温下,试管中所加试剂及用量/mL | 室温下,溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 |
H2O | 0.2mol/L KMnO4溶液 |
3mol/L H2SO4溶液 | ||
| 1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
| 3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
根据上表中的实验数据,可以得到的结论是
其他条件相同时,增大KMnO4浓度反应速率增大
其他条件相同时,增大KMnO4浓度反应速率增大
,试从活化分子和有效碰撞角度解释该结论反应物浓度增大,单位体积内的活化分子数增多,有效碰撞几率增大,反应速率增大
反应物浓度增大,单位体积内的活化分子数增多,有效碰撞几率增大,反应速率增大
.该小组同学根据经验绘制了n(Mn2+)随时间变化趋势的示意图,如图甲所示.但有同学查阅已有的资料发现,该实验过程中n(Mn2+)随时间变化的趋势如图乙所示.该小组同学根据乙图所示信息提出了新的假设,并继续进行实验探究.

该小组同学提出的假设是
生成物中的MnSO4(或Mn2+)为该反应的催化剂
生成物中的MnSO4(或Mn2+)为该反应的催化剂
请你帮助该小组同学完成实验方案,并填写下表中的空白
| 实验 编号 |
室温下,试管中所加试剂及用量/mL | 再向试管中加入少量固体 | 室温下,溶液褪至无色所需时间/min | |||
| 0.6mol/L H2C2O4溶液 |
H2O | 0.2mol/L KMnO4溶液 |
3mol/L H2SO4溶液 | |||
| 4 | 3.0 | 2.0 | 3.0 | 2.0 | MnSO4 MnSO4 (填写所加甲固体的化学式) |
t |
与实验1比较,溶液褪色的时间小于4min
与实验1比较,溶液褪色的时间小于4min
.分析:(1)从表中数据可知改变的条件是KMnO4浓度;反应物浓度增大,单位体积内的活化分子数增多,有效碰撞几率增大;
(2)由图乙可知反应开始后速率增大的比较快,作对比实验,其它条件相同时加入MnSO4,若反应加快,说明Mn2+是催化剂.
(2)由图乙可知反应开始后速率增大的比较快,作对比实验,其它条件相同时加入MnSO4,若反应加快,说明Mn2+是催化剂.
解答:解:(1)从表中数据可知改变的条件是KMnO4浓度;其他条件相同时,增大KMnO4浓度,反应速率增大,原因是反应物浓度增大,单位体积内的活化分子数增多,有效碰撞几率增大;
故答案为:其他条件相同时,增大KMnO4浓度反应速率增大;反应物浓度增大,单位体积内的活化分子数增多,有效碰撞几率增大,反应速率增大;
(2)由图乙可知反应开始后速率增大的比较快,说明生成物中的MnSO4(或Mn2+)为该反应的催化剂,作对比实验与与实验1比较,其它条件相同时加入MnSO4,若反应加快,溶液褪色的时间小于4min,说明Mn2+是催化剂;
故答案为:生成物中的MnSO4(或Mn2+)为该反应的催化剂; MnSO4;与实验1比较,溶液褪色的时间小于4min.
故答案为:其他条件相同时,增大KMnO4浓度反应速率增大;反应物浓度增大,单位体积内的活化分子数增多,有效碰撞几率增大,反应速率增大;
(2)由图乙可知反应开始后速率增大的比较快,说明生成物中的MnSO4(或Mn2+)为该反应的催化剂,作对比实验与与实验1比较,其它条件相同时加入MnSO4,若反应加快,溶液褪色的时间小于4min,说明Mn2+是催化剂;
故答案为:生成物中的MnSO4(或Mn2+)为该反应的催化剂; MnSO4;与实验1比较,溶液褪色的时间小于4min.
点评:本题主要结合实验考查了外界条件对化学反应速率的影响,题目难度不大,注意对比分析图表中的数据找出相同点和不同点.

练习册系列答案
相关题目
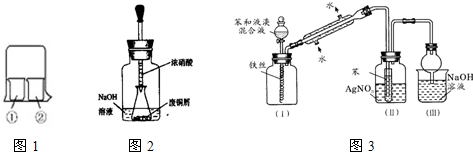
 饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一.某化学实验小组先制取氯气,后将其溶于水制成饱和氯水,并进行了如下定性研究:
饱和氯水与石灰石的反应是制取较浓HClO溶液的方法之一.某化学实验小组先制取氯气,后将其溶于水制成饱和氯水,并进行了如下定性研究: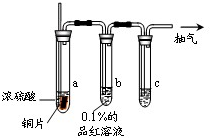 某实验小组同学为了探究铜与浓硫酸的反应,对教材中的装置进行简单改进,在大试管a中加了一根长玻璃导管(见图,图中夹持仪器和加热仪器没有画出).根据题意完成下列填空:
某实验小组同学为了探究铜与浓硫酸的反应,对教材中的装置进行简单改进,在大试管a中加了一根长玻璃导管(见图,图中夹持仪器和加热仪器没有画出).根据题意完成下列填空: