题目内容
短周期主族元素A、B、C、D、E原子序数依次增大,A是周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C原子的最外层电子数是次外层电子数的3倍,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物分子含有相同的电子数.
(1)A、C、D形成的化合物中含有的化学键类型为 .
(2)已知:
①E-E→2E△H=+a kJ?mol-1;
②2A→A-A△H=-b kJ?mol-1;
③E+A→A-E△H=-c kJ?mol-1;
写出298K时,A2与E2反应的热化学方程式 .
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g)?X(g)△H=-a kJ?mol-1(a>0,X为A、B、C三种元素组成的一种化合物).初始投料与各容器达到平衡时的有关数据如下:
①在该温度下,假设甲容器从反应开始到平衡所需时间为4min,则A2的平均反应速率v(A2)= .

②计算该温度下此反应的平衡常数K= .
③三个容器中的反应分别达平衡时各组数据关系正确的是 (填字母).
A.α1+α2=1
B.Q1+Q2=a
C.α3<α1
D.P3<2P1=2P2
E.n2<n3<1.0mol
F.Q3=2Q1
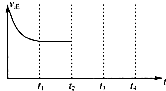
④在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为75%,请在图1中画出第5min到新平衡时X的物质的量浓度的变化曲线.
(4)熔融碳酸盐燃料电池(MCFC)是一种高温燃料电池,被称为第二代燃料电池.目前已接近商业化,示范电站规模已达2MW,从技术发展趋势来看,是未来民用发电的理想选择方案之一.现以A2(g)、BC(g)为燃料,以一定比例Li2CO3和Na2CO3低熔混合物为电解质.写出碳酸盐燃料电池(MCFC)正极电极反应式 .
(1)A、C、D形成的化合物中含有的化学键类型为
(2)已知:
①E-E→2E△H=+a kJ?mol-1;
②2A→A-A△H=-b kJ?mol-1;
③E+A→A-E△H=-c kJ?mol-1;
写出298K时,A2与E2反应的热化学方程式
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g)?X(g)△H=-a kJ?mol-1(a>0,X为A、B、C三种元素组成的一种化合物).初始投料与各容器达到平衡时的有关数据如下:
| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2molA2、1molBC | 1molX | 4molA2、2molBC |
| 平衡时n(X) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 | α1 | α2 | α3 |

②计算该温度下此反应的平衡常数K=
③三个容器中的反应分别达平衡时各组数据关系正确的是
A.α1+α2=1
B.Q1+Q2=a
C.α3<α1
D.P3<2P1=2P2
E.n2<n3<1.0mol
F.Q3=2Q1
④在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为75%,请在图1中画出第5min到新平衡时X的物质的量浓度的变化曲线.
(4)熔融碳酸盐燃料电池(MCFC)是一种高温燃料电池,被称为第二代燃料电池.目前已接近商业化,示范电站规模已达2MW,从技术发展趋势来看,是未来民用发电的理想选择方案之一.现以A2(g)、BC(g)为燃料,以一定比例Li2CO3和Na2CO3低熔混合物为电解质.写出碳酸盐燃料电池(MCFC)正极电极反应式
考点:位置结构性质的相互关系应用,热化学方程式,常见化学电源的种类及其工作原理,化学平衡常数的含义,物质的量或浓度随时间的变化曲线,化学平衡的计算
专题:基本概念与基本理论,元素周期律与元素周期表专题
分析:短周期主族元素A、B、C、D、E原子序数依次增大,A是周期表中原子半径最小的元素,则A为H元素;B是形成化合物种类最多的元素,则B为C元素;C原子的最外层电子数是次外层电子数的3倍,C原子只能有2个电子层,最外层电子数为6,故C为O元素;D是同周期中金属性最强的元素,处于ⅠA,结合原子序数可知,D处于第三周期,故D为Na;E的负一价离子与C的某种氢化物分子含有相同的电子数,可推知E为Cl,据此解答.
(1)活泼金属和活泼非金属元素之间易形成离子键、非金属元素之间易形成共价键;
(2)根据盖斯定律计算;
(3)①根据v=
计算;②根据平衡常数公式计算;③根据等效平衡分析;④根已知条件求出甲醇在5min和8min时的物质的量浓度,然后再作图即可;
(4)根据电极上得失电子书写电极反应式.
(1)活泼金属和活泼非金属元素之间易形成离子键、非金属元素之间易形成共价键;
(2)根据盖斯定律计算;
(3)①根据v=
| ||
| △t |
(4)根据电极上得失电子书写电极反应式.
解答:
解:短周期主族元素A、B、C、D、E原子序数依次增大,A是周期表中原子半径最小的元素,则A为H元素;B是形成化合物种类最多的元素,则B为C元素;C原子的最外层电子数是次外层电子数的3倍,C原子只能有2个电子层,最外层电子数为6,故C为O元素;D是同周期中金属性最强的元素,处于ⅠA,结合原子序数可知,D处于第三周期,故D为Na;E的负一价离子与C的某种氢化物分子含有相同的电子数,可推知E为Cl,
(1)A、C、D形成的化合物是NaOH,NaOH中钠离子和氢氧根离子之间存在离子键、H原子核O原子之间存在极性共价键,故答案为:离子键、极性键(或共价键);
(2)①E-E→2E△H=+a kJ?mol-1;
②2A→A-A△H=-b kJ?mol-1;
③E+A→A-E△H=-c kJ?mol-1;
将方程式①+②-2③得H2(g)+Cl2(g)=2HCl(g)△H=(a+b-2c)kJ?mol-1,
故答案为:H2(g)+Cl2(g)=2HCl(g)△H=(a+b-2c)kJ?mol-1;
(3)①在该温度下,假设甲容器从反应开始到平衡所需时间为4min,生成0.5molX需要n(A2)=2n(X)=1mol,则
=0.125mol?L-1?min-1,
故答案为:0.125mol?L-1?min-1;
②平衡时c(X)=
=0.25mol/L,c(A2)=
=0.5mol/L,c(BC)=
=0.25mol/L,则平衡常数K=
=4 L2/mol2,故答案为:4 L2/mol2;
③甲容器反应物投入2molH2、1molCO与乙容器反应物投入2mol CH3OH在保持恒温、恒容情况下是等效平衡,平衡时CH3OH的物质的量n2=0.5mol、p1=p2、α1+α2=1、Q1+Q2能量总变化相当于2molH2、1molCO完全转化成2mol CH3OH的能量,即吸放热Q1+Q2数值上就等于akJ;甲容器反应物投入量2molH2、1molCO与丙容器反应物投入量4molH2、2molCO,若恒温且丙容器容积是甲容器2倍,则甲容器与丙容器也是等效平衡,然而现在是温度、容积相同的3个密闭容器,我们可以当成是在恒温且容积是甲容器两倍条件下,体积受到了压缩,原反应正向气体体积减少,由平衡移动原理,则相较于甲容器(或假设状况)而言,丙容器平衡向逆向移动,也就是说,丙容器的转化率比甲容器还要低一些,因此α1+α2=1、Q1+Q2=a;α3>α1;P3<2P1=2P2、n3<n2<1.0mol、Q3>2Q1,故答案为:ABD;
④将甲容器的体系体积压缩到1L,若在第8min 达到新的平衡时,
2H2(g)+CO(g)?CH4O(g)
初始量:2 1 0
变化量:1.5 0.75 0.75
平衡量:0.5 0.25 0.75
所以达到平衡时,甲醇的物质的量浓度是0.75mol/L,在第5min时,由于体积减半,所以甲醇的浓度应该加倍,即为0.25mol/L×2=0.5mol/L,所以5-8min内,甲醇的物质的量浓度从0.5mol/L升高到0.75mol/L,如图所示:
故答案为: ;
;
(4)碳酸盐燃料电池正极上氧气得电子和二氧化碳反应生成碳酸根离子,电极反应式为O2+4e-+2CO2=2CO32-,故答案为:O2+4e-+2CO2=2CO32-.
(1)A、C、D形成的化合物是NaOH,NaOH中钠离子和氢氧根离子之间存在离子键、H原子核O原子之间存在极性共价键,故答案为:离子键、极性键(或共价键);
(2)①E-E→2E△H=+a kJ?mol-1;
②2A→A-A△H=-b kJ?mol-1;
③E+A→A-E△H=-c kJ?mol-1;
将方程式①+②-2③得H2(g)+Cl2(g)=2HCl(g)△H=(a+b-2c)kJ?mol-1,
故答案为:H2(g)+Cl2(g)=2HCl(g)△H=(a+b-2c)kJ?mol-1;
(3)①在该温度下,假设甲容器从反应开始到平衡所需时间为4min,生成0.5molX需要n(A2)=2n(X)=1mol,则
| ||
| 4min |
故答案为:0.125mol?L-1?min-1;
②平衡时c(X)=
| 0.5mol |
| 2L |
| (2-0.5×2)mol |
| 2L |
| (1-0.5)mol |
| 2L |
| 0.25mol/L |
| (0.5mol/L)2.(0.25mol/L) |
③甲容器反应物投入2molH2、1molCO与乙容器反应物投入2mol CH3OH在保持恒温、恒容情况下是等效平衡,平衡时CH3OH的物质的量n2=0.5mol、p1=p2、α1+α2=1、Q1+Q2能量总变化相当于2molH2、1molCO完全转化成2mol CH3OH的能量,即吸放热Q1+Q2数值上就等于akJ;甲容器反应物投入量2molH2、1molCO与丙容器反应物投入量4molH2、2molCO,若恒温且丙容器容积是甲容器2倍,则甲容器与丙容器也是等效平衡,然而现在是温度、容积相同的3个密闭容器,我们可以当成是在恒温且容积是甲容器两倍条件下,体积受到了压缩,原反应正向气体体积减少,由平衡移动原理,则相较于甲容器(或假设状况)而言,丙容器平衡向逆向移动,也就是说,丙容器的转化率比甲容器还要低一些,因此α1+α2=1、Q1+Q2=a;α3>α1;P3<2P1=2P2、n3<n2<1.0mol、Q3>2Q1,故答案为:ABD;
④将甲容器的体系体积压缩到1L,若在第8min 达到新的平衡时,
2H2(g)+CO(g)?CH4O(g)
初始量:2 1 0
变化量:1.5 0.75 0.75
平衡量:0.5 0.25 0.75
所以达到平衡时,甲醇的物质的量浓度是0.75mol/L,在第5min时,由于体积减半,所以甲醇的浓度应该加倍,即为0.25mol/L×2=0.5mol/L,所以5-8min内,甲醇的物质的量浓度从0.5mol/L升高到0.75mol/L,如图所示:

故答案为:
 ;
;(4)碳酸盐燃料电池正极上氧气得电子和二氧化碳反应生成碳酸根离子,电极反应式为O2+4e-+2CO2=2CO32-,故答案为:O2+4e-+2CO2=2CO32-.
点评:本题考查元素推断、化学键、热化学方程式的书写、化学平衡常数计算、平衡移动原理的综合应用、图象的分析和表达及新型电池的理解和应用,难点是等效平衡的分析,题目难度较大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列实验操作中正确的是( )
| A、蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 |
| B、蒸馏时,温度计水银球靠近蒸馏烧瓶的底部,且冷却水从冷凝管的下口通入上口流出 |
| C、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、向1 mol?L-1氯化铁溶液中加入少量的NaOH溶液制取氢氧化铁胶体 |
根据图示判断下列叙述符合事实的是( )
A、 连接好并放置片刻后,铁片会镀上一层铜 |
B、 连接好导线后(片与片相接触),电流表会发生明显偏转 |
C、 连接好并放置片刻后,在Zn片附近加一滴酚酞溶液,溶液变为红色 |
D、 发生反应为Fe+2H+═Fe2++H2↑时,a、b可能是同种材料的电板 |
 在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件下关于离子存在的说法中正确的是( )
在不同温度下,水溶液中c(H+)与c(OH-)有如图所示关系.下列条件下关于离子存在的说法中正确的是( )| A、c点对应的溶液中大量存在:Na+、Ba2+、Cl-、Fe2+ |
| B、b点对应的溶液中大量存在:NH4+、K+、Cl-、NO3- |
| C、d点对应的溶液中大量存在:Al3+、K+、ClO-、Cl- |
| D、a点对应的溶液中大量存在:CO32-、Na+、Cl-、SO42- |
 2013年9月,中国华北华中地区发生了严重的雾霆天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的C02等都是雾履形成的原因.
2013年9月,中国华北华中地区发生了严重的雾霆天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的C02等都是雾履形成的原因. 原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族.