题目内容
在25 ℃、101 kPa时,CH4(g)、H2(g)、C(s)的燃烧热分别是-890.3 kJ·mol-1、-285.8 kJ·mol-1和-393.5 kJ·mol-1,则CH4(g)―→C(s)+2H2(g)的ΔH是( )
| A.-74.8 kJ·mol-1 | B.+74.8 kJ·mol-1 |
| C.-211.0 kJ·mol-1 | D.+211.0 kJ·mol-1 |
B
解析

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案氯原子对O3的分解有催化作用:O3+Cl=ClO+O2 ΔH1 ClO+O=Cl+O2ΔH2
该反应的能量变化如图示意,下列叙述中正确的是
| A.反应O3+ O=2O2的ΔH=E1-E2 |
| B.反应O3+ O=2O2的ΔH=E2-E3 |
| C.反应O3+ O= 2O2是吸热反应 |
| D.反应O3+ O=2O2的ΔH=ΔH1+ΔH2 |
向足量H2SO4溶液中加入110 mL 0.4 mol/L Ba(OH)2溶液,放出的热量是5.12 kJ。如果向足量Ba(OH)2溶液中加入110 mL 0.4 mol/L HCl溶液时,放出的热量是2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为( )
| A.Ba2+(aq)+SO42—(aq)=BaSO4(s)ΔH=-0.72 kJ/mol |
| B.Ba2+(aq)+SO42—(aq)=BaSO4(s)ΔH=-2.92 kJ/mol |
| C.Ba2+(aq)+SO42—(aq)=BaSO4(s)ΔH=-16.4 kJ/mol |
| D.Ba2+(aq)+SO42—(aq)=BaSO4(s)ΔH=-73.0 kJ/mol |
已知:NH3·H2O(aq)与H2SO4(aq)反应生成1 mol正盐的ΔH=-24.2 kJ·mol-1;强酸、强碱的稀溶液反应的中和热为ΔH=-57.3 kJ·mol-1。则NH3·H2O在水溶液中电离的ΔH等于( )
| A.-69.4 kJ·mol-1 | B.-45.2 kJ·mol-1 |
| C.+69.4 kJ·mol-1 | D.+45.2 kJ·mol-1 |
在一定条件下A与B反应可生成C和D,其能量变化如图:
下列有关反应A+B=C+D的说法正确的是 ( )。
| A.反应前后原子的种类和数目一定不变 |
| B.反应前后分子的种类和数目一定改变 |
| C.反应物的总能量E1与生成物的总能量E2一定相等 |
| D.此反应一定有热量的变化 |
某反应在反应过程中的能量变化如图所示(图中E1表示反应物总能量,E2表示生成物总能量)。下列有关叙述正确的是( )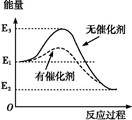
| A.该反应为吸热反应 |
| B.使用催化剂没有改变反应的反应热 |
| C.反应热等于E3-E2 |
| D.催化剂只对正反应有催化作用,对逆反应无催化作用 |
工业生产水煤气的反应为:C(s)+ H2O(g)=CO(g)+H2(g) ΔH=+131.4 kJ·mol-1,下列判断正确的是( )。
| A.反应物能量总和大于生成物能量总和 |
| B.CO(g)+H2(g)=C(s)+H2O(l) ΔH=-131.4 kJ·mol-1 |
| C.水煤气反应中生成1 mol H2(g)吸收131.4 kJ热量 |
| D.水煤气反应中生成1体积CO(g)吸收131.4 kJ热量 |
实验室中制备乙烯的方法是使乙醇脱水,反应可以简单地表示为CH3CH2OH―→CH2=CH2↑+H2O。已知CH2=CH2(g)和C2H5OH(l)的燃烧热分别是1 411.0 kJ·mol-1和1 366.8 kJ·mol-1。则实验室用C2H5OH(l)制备CH2=CH2(g)生成1 mol液态水的ΔH为( )
| A.-44.2 kJ·mol-1 |
| B.+44.2 kJ·mol-1 |
| C.-2 777.8 kJ·mol-1 |
| D.+2 777.8 kJ·mol-1 |
已知:NH3·H2O(aq)与H2SO4(aq)反应生成1 mol正盐的ΔH=
-24.2 kJ·mol-1;强酸、强碱的稀溶液反应的中和热ΔH=-57.3 kJ·mol-1。则NH3·H2O在水溶液中电离的ΔH等于( )
| A.-69.4 kJ·mol-1 | B.-45.2 kJ·mol-1 |
| C.+69.4 kJ·mol-1 | D.+45.2 kJ·mol-1 |