��Ŀ����
����Ŀ������Ԫ�����ڱ���һ���֣���Ա��б���Ģ١���Ԫ�أ���ش��й����⣺
�� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | �� | �� | �� |
��1�����л�ѧ��������õ�Ԫ�أ���ԭ�ӽṹʾ��ͼΪ��
��2�����н�������ǿ��Ԫ��������Ԫ�ط��ű�ʾ����ͬ�����ǽ�������ǿ��Ԫ���� �� �����뵼����ϵ���Ԫ�صĵ��ʣ�
��3���������γ��������������Ԫ���� �� д����Ԫ�صĵ�����������������ˮ���ﷴӦ�Ļ�ѧ����ʽ��
��4���������������ˮ����������ѧ��������
��5���١��ޡ�������Ԫ�ص�����������ˮ������������ǿ�������ѧʽ����
��6��Ԫ�آٵ����������ĵ���ʽ �� ��Ԫ�����Ԫ���γɻ�����ĵ���ʽ ��
���𰸡�
��1��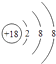
��2��Na��F��Si
��3��Al��2Al+2NaOH+2H2O�T2NaAlO2+3H2��
��4�����Ӽ������ۼ�
��5��HClO4
��6��![]() ��
��![]()
���������⣺����Ԫ�������ڱ�λ��֪���١���ֱ���Ԫ��C��N��F��Mg��Al��S��Cl��Ar��Na��SiԪ�أ�
��1.�����л�ѧ��������õ�Ԫ����Ar����ԭ�Ӻ�����3�����Ӳ㡢������������8����ԭ�ӽṹʾ��ͼΪ 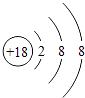 �����Դ��ǣ�
�����Դ��ǣ� 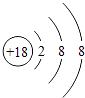 ��
��
��2.�����н�������ǿ��Ԫ��λ�����ڱ����½�ΪNaԪ�أ��ǽ�������ǿ��Ԫ��λ�����ڱ����Ͻ�ΪFԪ�أ�Si���뵼����ϣ����Դ��ǣ�Na��F��Si��
��3.���������γ��������������Ԫ����Al���������������ˮ������NaOH��Al��NaOH��Һ��Ӧ����ƫ�����ƺ���������Ӧ����ʽΪ2Al+2NaOH+2H2O�T2NaAlO2+3H2�������Դ��ǣ�Al��2Al+2NaOH+2H2O�T2NaAlO2+3H2����
��4.���������������ˮ������NaOH����������֮��������Ӽ����ǽ���Ԫ��֮���γɹ��ۼ��������Ӻ�����������֮��������Ӽ���O��Hԭ��֮����ڹ��ۼ������Դ��ǣ����Ӽ������ۼ���
��5.��Ԫ�صķǽ�����Խǿ��������������ˮ��������Խǿ���⼸��Ԫ�طǽ�������ǿ����ClԪ�أ�������������ˮ���ﻯѧʽΪHClO4 �� ���Դ��ǣ�HClO4��
��6.��Ԫ�آٵ���������������̼��������̼������C��ÿ��Oԭ��֮�乲��2�Ե��ӣ�����ʽΪ ![]() ����Ԫ�����Ԫ���γɻ������Ȼ�þ���Ȼ�þ��þ���Ӻ�������֮��������Ӽ�������ʽΪ
����Ԫ�����Ԫ���γɻ������Ȼ�þ���Ȼ�þ��þ���Ӻ�������֮��������Ӽ�������ʽΪ ![]() ��
��
���Դ��ǣ� ![]() ��
�� ![]() ��
��

